İçindekiler
AYT Kimya Asit-Baz Dengesi Konu Anlatımı
Asit–Baz Dengesi ünitesi, pH-pOH hesaplamaları, güçlü/zayıf asit-baz dengeleri ve tampon çözeltiler gibi önemli kavramları içerir. Hem kavramsal hem de işlem soruları gelebilir.
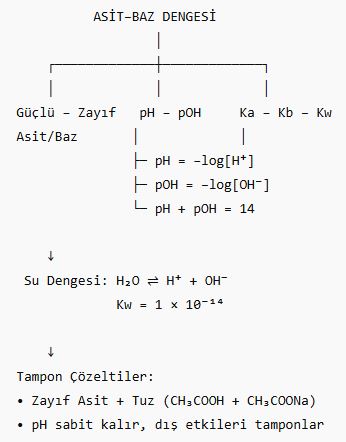
🔹 1. Asit ve Bazların Güçlü – Zayıf Tanımı
-
Güçlü Asit/Baz: Suda tamamen iyonlaşır.
-
Zayıf Asit/Baz: Suda kısmen iyonlaşır.

🔹 2. Su ve İyon Dengesi (Otoiyonizasyon)
Su kendi içinde çok az da olsa iyonlaşır:

🔹 3. pH ve pOH Kavramları
-
pH = –log[H⁺]
-
pOH = –log[OH⁻]
-
pH + pOH = 14
| Çözeltinin Türü | pH Aralığı |
|---|---|
| Asidik | 0–7 |
| Nötr | 7 |
| Bazik | 7–14 |
🔹 4. Güçlü Asit – Baz Çözeltilerinde pH Hesabı
Örnek (Asit):
0,01 M HCl → [H⁺] = 0,01 → pH = –log(0,01) = 2
Örnek (Baz):
0,001 M NaOH → [OH⁻] = 0,001 → pOH = 3 → pH = 11
🔹 5. Zayıf Asit – Baz Dengesi ve Ka – Kb
Zayıf asitlerde iyonlaşma tam değildir.
Ka: Asit iyonlaşma denge sabiti
Kb: Baz iyonlaşma denge sabiti
İlişki:
Ka × Kb = Kw
🔹 6. Tampon Çözeltiler
-
pH değişimine karşı dirençli çözeltilerdir.
-
Zayıf asit + konjugat baz (veya tersi)

Asit–Baz Dengesi – Kavram Haritası
Asit–Baz Dengesi Test,
1. [H⁺] = 1 × 10⁻³ M olan bir çözeltinin pH değeri nedir?
A) 2
B) 3
C) 4
D) 10
E) 11
2. [OH⁻] = 1 × 10⁻² M olan bir çözeltinin pOH ve pH değeri nedir?
A) pOH = 2, pH = 12
B) pOH = 12, pH = 2
C) pOH = 10, pH = 4
D) pOH = 4, pH = 10
E) pOH = 6, pH = 8
3. 0,001 M HCl çözeltisinin pH değeri kaçtır?
A) 1
B) 2
C) 3
D) 4
E) 5
4. pH + pOH toplamı kaçtır?
A) 0
B) 7
C) 10
D) 12
E) 14
5. Aşağıdakilerden hangisi zayıf bir bazdır?
A) NaOH
B) KOH
C) NH₃
D) Ca(OH)₂
E) LiOH
6. 1 × 10⁻⁵ M HNO₃ çözeltisinin pH değeri kaçtır?
A) 3
B) 4
C) 5
D) 6
E) 7
7. Ka × Kb = Kw ifadesi neyi açıklar?
A) Kuvvetli bazları
B) Asit-baz dengesini
C) Nötr çözeltileri
D) Tuz oluşumunu
E) Endotermik tepkimeleri
8. Aşağıdakilerden hangisi tampon çözeltiye örnektir?
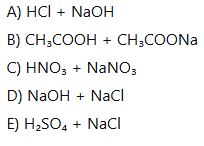
9. pH değeri 5 olan bir çözeltinin [H⁺] derişimi nedir?
A) 1 × 10⁻⁴
B) 1 × 10⁻⁵
C) 1 × 10⁻⁶
D) 5
E) 10
10. pOH = 3 olan bir çözeltinin pH değeri kaçtır?
A) 3
B) 7
C) 10
D) 11
E) 12
✅ Cevap Anahtarı:
-
B
-
A
-
C
-
E
-
C
-
C
-
B
-
B
-
B
-
C
