İçindekiler
AYT Kimya Gazlar Konu Anlatımı
Gazlar ünitesine geçiyoruz. Bu ünite, AYT Kimya’da sıkça işlem sorusu gelen, ideal gaz yasaları, gaz hacmi, kütle – mol ilişkileri gibi konuları içeren önemli bir bölümdür.
🔹 1. Gazların Özellikleri
-
Gaz tanecikleri arasında boşluk fazladır → sıkıştırılabilir
-
Tüm kabı doldurur, şekil ve hacim değiştirebilir
-
Tanecikler arasında etkileşim yok sayılır (ideal gaz varsayımı)
-
Düşük basınç, yüksek sıcaklıkta ideal davranırlar
🔹 2. Temel Gaz Büyüklükleri
| Büyüklük | Sembol | Birim |
|---|---|---|
| Basınç | P | atm, mmHg, Pa |
| Hacim | V | Litre (L) |
| Sıcaklık | T | Kelvin (K) |
| Mol | n | mol |
📌 Sıcaklık mutlaka Kelvin cinsinden alınır!
K = °C + 273
🔹 3. Gaz Yasaları
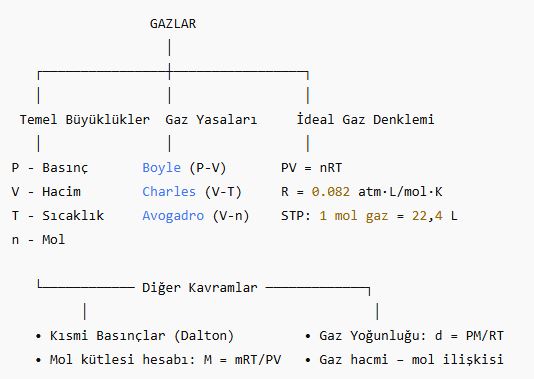
▪ Boyle Yasası (P–V):
![]()
Basınç arttıkça hacim azalır (ters orantı)
▪ Charles Yasası (V–T):
![]()
Sıcaklık arttıkça hacim artar (doğru orantı)
▪ Avogadro Yasası (V–n):
P ve T sabit → V/n = sabit
Mol sayısı artarsa hacim artar
🔹 4. İdeal Gaz Denklemi
📌 PV = nRT
-
R = Gaz sabiti = 0,082 atm·L/mol·K
-
Bu denklemde tüm değişkenler aynı anda bulunabilir.
Örnek:
2 mol gaz, 1 atm basınçta 273 K sıcaklıkta ne hacim kaplar?
V = nRT/P = (2 × 0,082 × 273) / 1 ≈ 44,8 L
🔹 5. Standart Şartlar (STP)
-
Sıcaklık: 0 °C = 273 K
-
Basınç: 1 atm
-
1 mol gaz hacmi: 22,4 L (ideal gaz için)
🔹 6. Dalton’un Kısmi Basınçlar Yasası
-
Kapalı bir kaptaki gazların toplam basıncı, her bir gazın kısmi basınçlarının toplamıdır.
P_toplam = P₁ + P₂ + P₃ + …
🔹 7. Gaz Yoğunluğu ve Mol Kütlesi
Yoğunluk formülü:
d = (P × M) / (R × T)
(M: mol kütlesi)
Mol kütlesi için:
M = (mRT) / PV
🔍 Örnek Soru:
Soru: 1 mol O₂ gazı, 1 atm basınç ve 273 K sıcaklıkta kaç litre hacim kaplar?
A) 11,2
B) 22,4
C) 44,8
D) 273
E) 0,082
Çözüm: STP’de 1 mol gaz = 22,4 L
Cevap: B
Gazlar Kavram Haritası
AYT Gazlar Testi
1. STP koşullarında 2 mol O₂ gazı kaç litre hacim kaplar?
A) 11,2
B) 22,4
C) 44,8
D) 56,0
E) 33,6
2. 1 atm basınç altında 0,5 mol gaz 22,4 L hacim kaplıyorsa sıcaklığı kaç Kelvin’dir? (R=0,082)
A) 273
B) 546
C) 298
D) 100
E) 150
3. Sabit sıcaklıkta basınç 2 katına çıkarsa gaz hacmi nasıl değişir?
A) 2 kat artar
B) 2 kat azalır
C) Yarıya iner
D) Sabit kalır
E) 4 kat azalır
4. 1 mol bir gazın 0°C ve 1 atm koşullarında hacmi kaçtır?
A) 11,2 L
B) 22,4 L
C) 44,8 L
D) 273 L
E) 0,082 L
5. 3 mol gazın hacmi 67,2 L ise bu gazın 1 molü kaç litre hacim kaplar?
A) 22,4
B) 33,6
C) 11,2
D) 44,8
E) 16,8
6. Dalton’a göre, toplam basınç 3 atm ve P₁ = 1 atm, P₂ = 0,5 atm ise P₃ kaçtır?
A) 1,5
B) 2,5
C) 3
D) 0,5
E) 1
7. İdeal gaz denklemi PV = nRT’te sıcaklık hangi birimle alınmalıdır?
A) Celsius
B) Fahrenheit
C) Kelvin
D) Joule
E) Santigrat
8. 1 mol CH₄ gazı 1 atm ve 300 K sıcaklıkta ne kadar hacim kaplar? (R=0,082)
A) 22,4
B) 24,6
C) 25,0
D) 20,4
E) 18,2
9. Gazların mol sayısı sabitken sıcaklık artarsa ne olur? (V sabit)
A) Basınç artar
B) Basınç azalır
C) Hacim artar
D) Hacim azalır
E) Hiçbiri
10. Sabit basınç altında sıcaklığı 300 K’den 600 K’ye çıkarılan gazın hacmi nasıl değişir?
A) Yarıya iner
B) 2 katına çıkar
C) Değişmez
D) 4 katına çıkar
E) 3 katına çıkar
✅ Cevap Anahtarı:
-
C
-
B
-
C
-
B
-
A
-
A
-
C
-
B
-
A
-
B
