Organik kimya, karbon temelli bileşiklerin yapısını, özelliklerini, tepkimelerini ve kullanım alanlarını inceleyen kimya dalıdır. Hayatın temel yapıtaşları olan karbon bileşiklerinin büyük bir kısmı bu alanda ele alınır. Canlı yapısındaki DNA’dan plastik malzemelere, ilaçlardan yakıtlara kadar birçok madde organik bileşiklerden oluşur.
Bu ünitede;
-
Organik bileşiklerin sınıflandırılması,
-
Adlandırma kuralları,
-
Yapı formülleri ve
-
İzomerlik türleri gibi temel kavramları öğreneceksin.
Ayrıca, alkoller, karboksilik asitler, alkanlar, alkenler, alkinler, esterler gibi fonksiyonel grupları tanıyacak ve bu bileşiklerin formüllerini yazmayı ve isimlendirmeyi öğreneceksin.
Organik kimya, hem ezber hem de mantık gerektiren bir alandır; bol örnek ve görsel üzerinden çalışmak konunun daha kolay anlaşılmasını sağlar.
İçindekiler
Organik Bileşiklerin Genel Özellikleri ve Sınıflandırılması
🔹 1. Organik Bileşiklerin Genel Özellikleri
-
Temel elementi karbon (C) olan bileşiklerdir.
-
Genellikle Hidrojen (H), Oksijen (O), Azot (N), Halojenler (F, Cl, Br, I) gibi elementler de bulunur.
-
Kovalent bağ içerirler.
-
Moleküler yapılıdırlar.
-
Yanıcıdırlar (çoğu karbonlu olduğu için).
-
Tepkime hızları genellikle yavaştır.
-
İzomer sayısı fazladır.
-
Yaşamsal süreçlerde çok büyük öneme sahiptirler (DNA, protein, glikoz vb.).
🔹 2. Organik – Anorganik Karşılaştırması
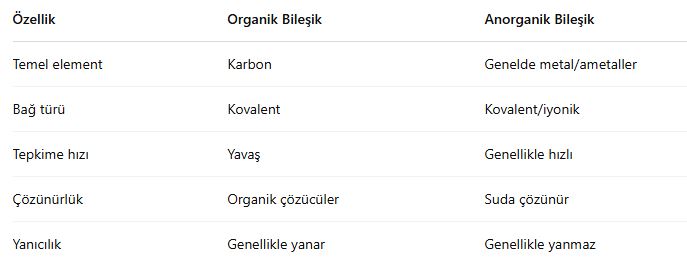
🔹 3. Organik Bileşiklerin Sınıflandırılması
Organik bileşikler fonksiyonel gruplarına göre sınıflandırılır. İşte başlıca organik bileşik türleri:

🔹 4. Organik Bileşiklerin Adlandırılmasına Giriş
Adlandırma genellikle IUPAC (uluslararası sistem) üzerinden yapılır. Temel kurallar:
-
En uzun karbon zinciri bulunur.
-
Fonksiyonel grup numaralandırılır.
-
Yan gruplar isimlendirilir.
-
Son ek, bileşik türünü belirtir (–an, –ol, –al, –on, –oik asit…)
Detaylı adlandırma kurallarını her bileşik grubunda ayrı ayrı işleyeceğiz.
🔍 Örnek Soru:
Soru: Aşağıdakilerden hangisi bir alkin bileşiğidir?
A) C₂H₆
B) C₂H₄
C) C₂H₂
D) CH₃OH
E) CH₃COOH
Çözüm:
Alkinler C≡C (üçlü bağ) içerir ve genel formülü CnH₂n–2’dir.
C₂H₂ → Etin (alkin sınıfı)
Cevap: C
Alkanlar
🔹 1. Alkanların Genel Özellikleri
-
Sadece tekli bağ (C–C) içerirler.
-
Genel formülleri: CnH₂n+2
-
Doymuş hidrokarbonlardır.
-
Tüm bağları sigma (σ) bağıdır.
-
Zincirli, dallanmış ya da halka yapıda olabilirler.
-
Tepkimeye girme eğilimleri düşüktür. (En kararlı hidrokarbonlar)
🔹 2. Alkanların Adlandırılması (IUPAC Sistemi)
Adım adım:
-
En uzun karbon zinciri bulunur.
-
Zincir numaralandırılır, yan gruplar en küçük numaraları alacak şekilde.
-
Yan gruplar –il ekiyle adlandırılır.
-
Yan grup sayısı fazla ise alfabetik sıraya göre yazılır.
-
Aynı grup birden fazla ise di–, tri–, tetra– gibi ön ekler kullanılır.
İlk beş alkanın adı:
| Karbon Sayısı | Adı | Formül |
|---|---|---|
| 1 | Metan | CH₄ |
| 2 | Etan | C₂H₆ |
| 3 | Propan | C₃H₈ |
| 4 | Bütan | C₄H₁₀ |
| 5 | Pentan | C₅H₁₂ |
🔹 3. İzomerlik
-
Alkanlarda karbon sayısı arttıkça izomer sayısı da artar.
-
İzomer: Aynı formüle sahip, farklı yapıdaki bileşikler.
-
İzomerlik, 4 karbonlu alkanlardan itibaren başlar (bütan ve üzeri).
🔹 4. Alkanların Tepkimeleri
-
Yanma tepkimesi: Alkanlar oksijenle tepkimeye girerek CO₂ ve H₂O oluşturur.
CH₄ + 2O₂ → CO₂ + 2H₂O -
Halojenle yer değiştirme (substitüsyon):
CH₄ + Cl₂ → CH₃Cl + HCl
🔹 5. Alkil Grupları
-
Alkanlardan bir hidrojen çıkarsa –il son ekini alır:
CH₄ → CH₃– (metil)
C₂H₆ → C₂H₅– (etil)
🔍 Örnek Soru:
Soru: Aşağıdakilerden hangisi C₄H₁₀ bileşiğinin bir izomeridir?
A) CH₄
B) CH₃CH₂CH₂CH₃
C) C₂H₂
D) C₄H₈
E) CH₃COOH
Çözüm:
C₄H₁₀’un bir izomeri CH₃CH(CH₃)CH₃ (izobütan) olabilir.
CH₃CH₂CH₂CH₃ → düz zincirli bütan (bir izomeridir)
Cevap: B
Alkenler
🔹 1. Alkenlerin Genel Özellikleri
-
En az bir tane çift bağ (C=C) içeren doymamış hidrokarbonlardır.
-
Genel formülleri: CnH₂n
-
Çift bağ nedeniyle reaktiftirler, özellikle katılma (addisyon) tepkimelerine girerler.
-
En küçük alken: Eten (C₂H₄)
-
İki karbon arasında bir sigma (σ) ve bir pi (π) bağı bulunur.
🔹 2. Alkenlerin Adlandırılması (IUPAC)
Adım adım:
-
En uzun zincir, çift bağı içerecek şekilde seçilir.
-
Karbonlar, çift bağ en küçük numarayı alacak şekilde numaralandırılır.
-
Çift bağın konumu numara ile belirtilir (örnek: but-1-en).
-
Yan gruplar aynı şekilde adlandırılır.
-
Birden fazla çift bağ varsa: dien, trien gibi ekler kullanılır.
Örnek Alkenler:
| Karbon Sayısı | Adı | Yapısı |
|---|---|---|
| 2 | Eten | CH₂=CH₂ |
| 3 | Propen | CH₂=CH–CH₃ |
| 4 | Büt-1-en | CH₂=CH–CH₂–CH₃ |
🔹 3. Alkenlerin Tepkimeleri
▪ Katılma Tepkimeleri (Addisyon):
Çift bağ, reaktif olduğu için moleküller katılır ve bağ açılır.
-
Hidrojen katılması (Hidrojenerasyon):
CH₂=CH₂ + H₂ → CH₃–CH₃ -
Halojen katılması:
CH₂=CH₂ + Br₂ → CH₂Br–CH₂Br -
Su katılması (Hidrasyon):
CH₂=CH₂ + H₂O → CH₃–CH₂OH
▪ Yanma Tepkimesi:
Alkenler de tıpkı alkanlar gibi oksijenle yanar:
C₂H₄ + 3O₂ → 2CO₂ + 2H₂O
🔹 4. Cis–Trans (Geometrik) İzomerlik
-
Çift bağ etrafında dönme olmadığı için alkenlerde cis–trans izomerliği görülebilir.
-
Cis izomer: Benzer gruplar aynı tarafta
-
Trans izomer: Benzer gruplar zıt tarafta
🔍 Örnek Soru:
Soru: Aşağıdaki bileşiklerden hangisi bir alken grubuna aittir?
A) CH₄
B) C₂H₂
C) C₂H₆
D) C₂H₄
E) C₆H₆
Çözüm:
C₂H₄ (eten), çift bağ içerir → alken grubundadır.
Cevap: D
Alkinler
🔹 1. Alkinlerin Genel Özellikleri
-
En az bir tane üçlü bağ (C≡C) içerirler.
-
Doymamış hidrokarbonlardır.
-
Genel formülleri: CnH₂n–2
-
Reaktiftirler; özellikle katılma (addisyon) tepkimelerine girerler.
-
Alkenlerden daha reaktiftirler çünkü üçlü bağ daha yüksek enerji içerir.
-
En küçük alkin: Etin (asetilen) → C₂H₂
🔹 2. Alkinlerin Adlandırılması (IUPAC)
Adım adım:
-
En uzun karbon zinciri, üçlü bağı içerecek şekilde seçilir.
-
Zincir, üçlü bağ en küçük numarayı alacak şekilde numaralandırılır.
-
Üçlü bağın yeri numara ile belirtilir (örnek: büt-1-in).
-
Yan gruplar uygun şekilde adlandırılır.
-
Birden fazla üçlü bağ varsa: diin, triin gibi ekler kullanılır.
Örnek Alkinler:
| Karbon Sayısı | Adı | Yapısı |
|---|---|---|
| 2 | Etin (asetilen) | CH≡CH |
| 3 | Propin | CH≡C–CH₃ |
| 4 | Büt-1-in | CH≡C–CH₂–CH₃ |
🔹 3. Alkinlerin Tepkimeleri
▪ Katılma Tepkimeleri (Addisyon):
-
Hidrojen katılması:
CH≡CH + 2H₂ → CH₃–CH₃ -
Halojen katılması:
CH≡CH + 2Br₂ → CHBr₂–CHBr₂ -
Su katılması:
H₂O, Hg²⁺ ve H⁺ varlığında → keton/aldehit oluşabilir
▪ Yanma Tepkimesi:
C₂H₂ + 2.5O₂ → 2CO₂ + H₂O
🔹 4. Uç Alkinler ve Asidik Özellik
-
Uç alkinler: Üçlü bağ karbon zincirinin sonunda yer alır.
-
Uç alkinler zayıf asidik özellik gösterir ve sodyum metal ile tepkimeye girer:
CH≡CH + Na → CH≡C⁻Na⁺ + ½H₂↑
🔍 Örnek Soru:
Soru: C₃H₄ bileşiği aşağıdaki hangi bileşik grubuna aittir?
A) Alkan
B) Alken
C) Alkin
D) Aromatik
E) Alkol
Çözüm:
Genel formül CnH₂n–2 → C₃H₄, bir alkindir.
Cevap: C
Aromatik Bileşikler
🔹 1. Aromatik Bileşik Nedir?
-
Aromatik bileşikler, benzen halkası (C₆H₆) veya benzer yapılar içeren halkalı ve özel kararlılığa sahip bileşiklerdir.
-
Yapılarında konjuge π bağları (çift ve tek bağların dönüşümlü dizilimi) bulunur.
-
Doymamış görünmelerine rağmen kararlıdırlar ve kolay tepkime vermezler.
-
En bilinen aromatik bileşik: Benzen (C₆H₆)
🔹 2. Benzen ve Yapısı
-
6 karbonlu halkasal yapıdır.
-
Her karbon, bir hidrojenle bağlıdır.
-
Çift ve tek bağlar sürekli yer değiştirir → rezonans yapısı
-
Molekül düzlemseldir ve delokalize π elektron bulutu içerir.
Gösterimi:
🔁 Altıgen içinde bir daire ile ifade edilir.
🔹 3. Benzen Türevleri
Benzen halkasındaki H atomlarının yerine başka gruplar geldiğinde türevler oluşur.
Tek Substitüe (tek grup bağlı):
-
Metil benzen (Toluen): C₆H₅–CH₃
-
Nitro benzen: C₆H₅–NO₂
-
Fenol: C₆H₅–OH
-
Anilin: C₆H₅–NH₂
Di-substitüe (iki grup bağlı):
-
Ortho (o–): 1,2 konum
-
Meta (m–): 1,3 konum
-
Para (p–): 1,4 konum
🔹 4. Aromatiklik Kriterleri (Hückel Kuralı)
Bir bileşiğin aromatik sayılabilmesi için:
✅ Halkasal olmalı
✅ Düzlemsel olmalı
✅ (4n + 2) π elektronu içermeli (n = 0, 1, 2…)
✅ Konjuge π bağlara sahip olmalı
Benzen → 6 π elektronu → Aromatiktir
🔹 5. Tepkime Özellikleri
-
Alkenler gibi katılma tepkimesi vermezler.
-
Genellikle yer değiştirme (substitüsyon) tepkimeleri verirler:
C₆H₆ + Br₂ → C₆H₅Br + HBr
🔍 Örnek Soru:
Soru: Aşağıdakilerden hangisi aromatik bir bileşiktir?
A) C₂H₆
B) C₆H₆
C) C₂H₂
D) CH₃OH
E) CH₃COOH
Çözüm:
C₆H₆ (benzen), halkalı ve aromatik özellik gösterir.
Cevap: B
Alkoller
🔹 1. Alkollerin Genel Özellikleri
-
Yapılarında en az bir tane –OH (hidroksil) grubu taşıyan organik bileşiklerdir.
-
Genel formül: R–OH (R: alkil grubu)
-
Polar bileşiklerdir, hidrojen bağı yapabilirler.
-
Suda çözünürlük ve kaynama noktası, karbon sayısına ve OH sayısına bağlıdır.
-
Yanıcıdırlar.
🔹 2. Alkollerin Sınıflandırılması
▪ OH grubunun bağlı olduğu karbon atomuna göre:
| Tür | Tanım | Örnek |
|---|---|---|
| 1° (birincil) | OH bağlı karbon, bir başka C’ye bağlı | CH₃CH₂OH (etanol) |
| 2° (ikincil) | OH bağlı karbon, iki başka C’ye bağlı | CH₃CHOHCH₃ (izopropanol) |
| 3° (üçüncül) | OH bağlı karbon, üç başka C’ye bağlı | (CH₃)₃COH (tertiyer butanol) |
🔹 3. IUPAC Adlandırma
-
En uzun karbon zinciri seçilir, OH grubu önceliklidir.
-
Zincir numaralandırılır, OH en küçük numarayı alır.
-
“–an” son eki, “–ol” olarak değiştirilir.
-
OH’un yeri belirtilir. Yan gruplar varsa adlandırılır.
Örnek:
CH₃CH₂CH₂OH → Propan-1-ol
CH₃CHOHCH₃ → Propan-2-ol
🔹 4. Alkollerin Tepkimeleri
▪ Yanma:
C₂H₅OH + 3O₂ → 2CO₂ + 3H₂O
▪ Dehidrasyon (su çıkarma):
Yüksek sıcaklıkta alkolden su çıkar → alken oluşur.
CH₃CH₂OH → CH₂=CH₂ + H₂O
▪ Oksidasyon:
-
1° alkol → aldehit → karboksilik asit
-
2° alkol → keton
-
3° alkoller kolayca oksitlenmez.
🔹 5. Çok Hidroksilli Alkoller
-
Birden fazla OH grubu taşıyan bileşiklerdir.
-
Glikol (etan-1,2-diol), gliserol (propan-1,2,3-triol) örneklerindendir.
-
Genellikle tatlımsı, viskoz ve higroskopik maddelerdir.
🔍 Örnek Soru:
Soru: CH₃CH₂OH bileşiği hangi sınıf alkoldür ve adı nedir?
A) 1°, etanol
B) 2°, propanol
C) 3°, metanol
D) 1°, propanol
E) 2°, etanol
Çözüm:
–OH grubu uçtaki karbon üzerinde → birincil alkol. 2 karbon → etanol
Cevap: A
Eterler
🔹 1. Eterlerin Genel Özellikleri
-
Eterler, yapılarında –O– (oksijen) atomu bulunan ve bu atomun iki karbon atomu ile bağlandığı organik bileşiklerdir.
-
Genel formül: R–O–R’ (R ve R’ alkil gruplarıdır)
-
Apolar bileşiklerdir, ancak düşük moleküler ağırlıklı olanlar suda çözünebilir.
-
Yüksek kaynama noktalarına sahiptir, fakat alkollere göre kaynama noktası daha düşüktür.
-
Yanıcıdırlar.
-
Çözücü olarak yaygın bir şekilde kullanılırlar.
🔹 2. Eterlerin Adlandırılması (IUPAC)
-
En uzun alkil zinciri seçilir ve buna göre isimlendirilir.
-
Alkil gruplarının adları birbirine bağlanarak ve ardından “eter” son eki eklenir.
Örnekler:
-
Dimetil eter: CH₃–O–CH₃
-
Etil metil eter: CH₃–O–C₂H₅
🔹 3. Eterlerin Yapısı
-
Eterler, düz zincirli veya dallanmış olabilir.
-
Yapılarındaki oksijen atomu, sp³ hibridleşmesi yapar ve 2 bağ yapar.
-
Eterler genellikle poları çok düşük olan bileşiklerdir ve bu yüzden apolar çözücüler olarak kullanılır.
🔹 4. Eterlerin Tepkimeleri
▪ Yanma:
Eterler yanıcıdır ve yanma tepkimesi verirler:
C₂H₅–O–C₂H₅ + 9O₂ → 6CO₂ + 6H₂O
▪ Nükleofilik Substitüsyon (Alkilasyon):
Eterler asidik ortamlarda nükleofilik sürekli reaksiyonlar verir.
CH₃O–CH₃ + HCl → CH₃Cl + CH₃OH
▪ Hidroliz:
Eterler, suyla parçalanabilir ve alkoller oluşturabilirler.
CH₃–O–CH₃ + H₂O → 2 CH₃OH
🔹 5. Eterlerin Kullanım Alanları
-
Çözücü olarak kullanılır.
-
Anestezik olarak eskiden yaygın bir şekilde kullanılmıştır (örneğin, diethylether).
-
Laboratuvar ortamlarında çokça kullanılır.
🔍 Örnek Soru:
Soru: Aşağıdaki bileşiklerden hangisi bir eter bileşiğidir?
A) CH₃OH
B) C₂H₅–O–C₂H₅
C) CH₄
D) CH₃COOH
E) C₆H₆
Çözüm:
C₂H₅–O–C₂H₅, oksijen atomu ile bağlanan iki alkil grubuna sahip ve bu da bir eteri oluşturur.
Cevap: B
Aldehitler ve Ketonlar
🔹 1. Aldehitler
-
Aldehitler, yapılarında bir karbonil grubu (C=O) taşıyan organik bileşiklerdir.
-
Karbonil grubuna bağlı olan en az bir grup hidrojen (–H) olmalıdır.
-
Genel formül: R–CHO (R: alkil veya aril grubu)
-
Reaktif bileşiklerdir ve birçok kimyasal reaksiyona girerler.
Adlandırma (IUPAC):
-
En uzun karbon zinciri seçilir ve sonuna –al eki eklenir.
-
Örnek:
-
Metanal (formaldehit): H–CHO
-
Etenal (asetaldehit): CH₃–CHO
-
Aldehitlerin Tepkimeleri:
-
Oksidasyon: Aldehitler kolayca oksitlenebilir.
R–CHO + O₂ → R–COOH (karboksilik asit) -
Redüksiyon: Aldehitler, indirgenme ile alkole dönüşebilir.
R–CHO + H₂ → R–CH₂OH (Alkol)
🔹 2. Ketonlar
-
Ketonlar, karbonil grubunun bir alkil grubu ile bağlandığı organik bileşiklerdir.
-
Karbonil grubuna iki alkil grubu bağlanmıştır.
-
Genel formül: R–CO–R’ (R ve R’ alkil gruplarıdır)
-
Doymuş ve apolar yapıları nedeniyle çözücü olarak yaygın şekilde kullanılır.
Adlandırma (IUPAC):
-
En uzun karbon zinciri seçilir ve –on eki eklenir.
-
Örnekler:
-
Propanon (Aseton): CH₃–CO–CH₃
-
Butanon: CH₃–CO–C₂H₅
-
Ketonların Tepkimeleri:
-
Oksidasyon: Ketonlar genellikle kolayca oksitlenmezler.
-
Redüksiyon: Ketonlar, aldehitlere dönüşebilir.
R–CO–R’ + H₂ → R–CH(OH)–R’
🔹 3. Aldehitler ve Ketonların Kullanım Alanları
▪ Aldehitler:
-
Formaldehit: Dondurucu ve dezenfektan olarak kullanılır.
-
Asetaldehit: Alkollü içeceklerin fermantasyonunda ortaya çıkar.
▪ Ketonlar:
-
Aseton: Yaygın bir çözücüdür, tırnak cilası temizleyici olarak kullanılır.
-
Ketonlar genellikle çözücü, temizlik maddesi ve bazı ilaçların yapısında bulunur.
🔍 Örnek Soru:
Soru: Aşağıdaki bileşiklerden hangisi bir keton bileşiğidir?
A) CH₃OH
B) CH₃COOH
C) C₂H₅–CHO
D) CH₃COCH₃
E) CH₃–CH₂OH
Çözüm:
CH₃COCH₃, karbonil grubuna bağlanan iki alkil grubu ile bir keton bileşiğidir.
Cevap: D
Karboksilik Asitler
🔹 1. Karboksilik Asitlerin Genel Özellikleri
-
Karboksilik asitler, yapılarında karboksil grubu (-COOH) taşıyan organik bileşiklerdir.
-
Karboksil grubu, bir karbonil grubu (C=O) ve bir hidroksil grubu (–OH) içerir.
-
Genel formül: R–COOH
-
Suda çözünürler, çünkü hidrojen bağları oluşturabilirler.
-
Asidik özellik gösterirler ve proton verirler (H⁺).
-
Karboksilik asitlerin kaynama noktası, aynı karbon sayısına sahip alkanlara göre daha yüksektir.
🔹 2. Karboksilik Asitlerin Adlandırılması (IUPAC)
Adım adım:
-
En uzun karbon zinciri seçilir.
-
Zincire –COOH grubu bağlanır ve adlandırmada en düşük numara verilir.
-
–oik asit eki eklenir.
Örnekler:
-
Metanoik Asit (Formik Asit): HCOOH
-
Etanoik Asit (Asetik Asit): CH₃COOH
-
Propanoik Asit: CH₃CH₂COOH
-
Bütanoik Asit: CH₃CH₂CH₂COOH
🔹 3. Karboksilik Asitlerin Tepkimeleri
▪ Asidik Tepkime:
Karboksilik asitler, su ile tepkimeye girerek proton (H⁺) verirler.
CH₃COOH + H₂O → CH₃COO⁻ + H₃O⁺
▪ Estereşme (Esterleşme):
Karboksilik asitler, alkollerle reaksiyona girerek esterler oluştururlar.
CH₃COOH + CH₃OH → CH₃COOCH₃ + H₂O
(Asetik asit + metanol → metil asetat + su)
▪ Asidik Redüksiyon:
Karboksilik asitler alkol ve aldehitlere indirgenebilirler.
CH₃COOH + 4[H] → CH₃CH₂OH (Etanol)
🔹 4. Karboksilik Asitlerin Kullanım Alanları
-
Asetik Asit: Sirke üretiminde kullanılır.
-
Formik Asit: Böcek ilaçlarında ve deri işleme sanayisinde kullanılır.
-
Yağlar ve Sabunlar: Yağ asitleri ve sabunların yapısında yer alır.
-
Aromatik Asitler: Kimyasal endüstride yaygın olarak kullanılır (örneğin, tereftalik asit).
🔍 Örnek Soru:
Soru: Aşağıdaki bileşiklerden hangisi karboksilik asit grubuna aittir?
A) CH₃OH
B) C₂H₅OH
C) CH₃COOH
D) CH₄
E) C₆H₆
Çözüm:
CH₃COOH, karboksil grubu içerdiği için karboksilik asittir.
Cevap: C
Esterler
🔹 1. Esterlerin Genel Özellikleri
-
Esterler, bir karboksil grubu (–COOH) ile bir alkol grubu (–OH) arasında oluşan bileşiklerdir.
-
Genel formül: RCOOR’ (R ve R’ alkil gruplarıdır)
-
Tatlı kokuludur ve aromatik bileşiklerdir, bu yüzden parfümler, esanslar, gıda maddeleri gibi birçok üründe kullanılırlar.
-
Suda çözünürlükleri genellikle düşüktür, ancak düşük moleküler ağırlıklı esterler suda çözünebilen bileşiklerdir.
-
Esterler genellikle yanıcıdır.
🔹 2. Esterleşme Tepkimesi
Esterler, karboksilik asitler ile alkoller arasında gerçekleşen esterleşme (asetik esterleşme) tepkimesiyle oluşurlar.
Genel Reaksiyon:
Karboksilik Asit + Alkol → Ester + Su
RCOOH + R’OH → RCOOR’ + H₂O
Örnek:
Asetik Asit + Etanol → Etil Asetat + Su
CH₃COOH + C₂H₅OH → CH₃COOC₂H₅ + H₂O
🔹 3. Esterlerin Adlandırılması
-
Alkol kısmı: Alkil grubu adlandırılır.
-
Asit kısmı: Karboksil grubunun bağlı olduğu alkil kısmı –at eki ile adlandırılır.
Örnek:
-
Metil Asetat: CH₃COOCH₃
-
Etil Asetat: CH₃COOC₂H₅
🔹 4. Esterlerin Tepkimeleri
-
Hidroliz (Esterin Suyla Parçalanması):
Esterler, asidik veya bazik ortamda hidroliz ile tekrar karboksilik asit ve alkol verirler.
CH₃COOC₂H₅ + H₂O → CH₃COOH + C₂H₅OH
(Ester + Su → Asit + Alkol)
🔹 5. Esterlerin Kullanım Alanları
-
Parfümler ve Esanslar: Esterler tat ve kokularından dolayı parfüm ve esans üretiminde kullanılır.
-
Gıda Endüstrisi: Meyve esansları ve aromalar için esterler kullanılır.
-
Çözücüler: Alkol bazlı esterler, yüzey temizleyiciler ve renk çözücüler olarak kullanılır.
🔍 Örnek Soru:
Soru: Aşağıdaki bileşiklerden hangisi bir ester bileşiğidir?
A) CH₃COOH
B) C₆H₆
C) CH₃COOC₂H₅
D) CH₄
E) CH₃OH
Çözüm:
CH₃COOC₂H₅, bir ester bileşiği olup metil asetat olarak adlandırılır.
Cevap: C
Aminler
🔹 1. Aminlerin Genel Özellikleri
-
Aminler, yapılarında bir veya daha fazla azot (N) atomu bulunduran organik bileşiklerdir.
-
Ammonyak (NH₃), aminlerin en basit türevidir.
-
Genel formül: R–NH₂, R₂NH, R₃N
-
Aminler, bazik özellik gösterirler çünkü azot atomu bir elektron çiftine sahiptir ve bu çift, proton (H⁺) alabilir.
-
Genellikle suda çözünürler, ancak çözünürlük, zincirin uzunluğuna ve alkil grubuna bağlı olarak değişir.
-
Kötü kokulu olabilirler ve genellikle alkalik özellikler taşır.
🔹 2. Aminlerin Adlandırılması (IUPAC)
Aminlerin adlandırılması iki şekilde yapılır:
-
Basit Aminler: Azotun bağlı olduğu alkil grubunun adı, ardından –amin eklenir.
-
Metilamin: CH₃NH₂
-
Etilamin: C₂H₅NH₂
-
-
Çift bağlı Aminler (Diyaminler): Eğer azot iki alkil grubu ile bağlıysa, di- eki eklenir.
-
Dimetilamin: (CH₃)₂NH
-
Daha karmaşık yapılar: Eğer bir amin grubuna başka fonksiyonel gruplar bağlanmışsa, IUPAC adlandırma kuralları izlenir.
🔹 3. Aminlerin Tepkimeleri
▪ Asidik Tepkime (Aminlerin Protokol Tuzu Oluşturması):
Aminler, asidik ortamlarda proton (H⁺) alarak amonyum tuzları oluştururlar:
R–NH₂ + H⁺ → R–NH₃⁺
▪ Aminlerin Oksitlenmesi:
Aminler oksitlenebilir, ancak genellikle doğrudan oksitlenmezler. Ancak bazı aminler, nitrojen oksitleri gibi bileşiklere dönüşebilir.
▪ Alkilasyon (Sürekli Reaksiyon):
Aminler, alkil halojenürleriyle reaksiyona girerek alkil aminler oluştururlar.
R–NH₂ + R’–Cl → R–NH–R’ + HCl
🔹 4. Aminlerin Kullanım Alanları
-
Biyolojik Sistemde: Aminler, amino asitlerin yapı taşlarıdır ve protein sentezi için gereklidir.
-
İlaçlar: Aminler, birçok ilacın yapısında bulunur. Örneğin, antibiyotikler ve antihistaminikler.
-
Deterjanlar ve Boyalar: Amin grupları, deterjanlar ve renkli boyalar yapısında bulunabilir.
🔍 Örnek Soru:
Soru: Aşağıdaki bileşiklerden hangisi bir amin bileşiğidir?
A) CH₃COOH
B) CH₃NH₂
C) C₂H₆
D) C₆H₆
E) CH₄
Çözüm:
CH₃NH₂, bir amin bileşiğidir ve metilamin olarak bilinir.
Cevap: B
Polimerler
🔹 1. Polimer Nedir?
-
Polimerler, çok sayıda küçük birim (monomer) bir araya gelerek oluşturdukları uzun zincir yapılarına denir.
-
Monomerler, polimerlerin yapı taşlarıdır.
-
Polimerleşme, monomerlerin kimyasal bağlarla birleşerek daha büyük moleküller (polimerler) oluşturması sürecidir.
-
Polimerler genellikle yüksek moleküler ağırlığa sahiptir.
🔹 2. Polimerleşme Yöntemleri
▪ Ekleme Polimerleşmesi (Zincir Polimerleşmesi):
-
Monomerler arasındaki çift bağlar açılır ve birbirine bağlanarak uzun zincirler oluşturulur.
-
Bu reaksiyon, genellikle radikal, iyonik, veya ışıkla başlatılan süreçlerle başlatılır.
-
Polietilen (PE), polipropilen (PP) bu yönteme örnek verilebilir.
Örnek:
Eten → Polietilen
n CH₂=CH₂ → (–CH₂–CH₂–)ₙ
▪ Kondenzasyon Polimerleşmesi (Adisyon Polimerleşmesi):
-
İki monomer, genellikle bir su molekülü çıkararak birleşir.
-
Poliamidler, polieterler gibi bileşikler bu yönteme örnek verilebilir.
Örnek:
Tereftalik Asit + Etilen Glikol → Polietilen Tereftalat (PET)
n C₆H₄(CO₂H)₂ + n HOCH₂CH₂OH → (–C₆H₄CO₂–CH₂CH₂O–)ₙ + n H₂O
🔹 3. Polimerlerin Sınıflandırılması
Polimerler, genel olarak iki ana gruba ayrılır:
▪ Doğal Polimerler:
-
Doğada bulunan, biyolojik kaynaklardan elde edilen polimerlerdir.
-
Selüloz, proteinler, DNA, nişasta doğal polimerlere örnek verilebilir.
▪ Sentetik Polimerler:
-
Kimyasal süreçlerle laboratuvar ortamında üretilen polimerlerdir.
-
Polietilen, polipropilen, polistiren gibi plastikler sentetik polimerlere örnektir.
🔹 4. Polimerlerin Özellikleri
-
Fiziksel Durum: Polimerler katı, sıvı veya gaz olabilirler.
-
Mekanik Özellikler: Polimerler sert veya esnek olabilirler.
-
Çözünürlük: Polimerler, çözücülerle çözünürlük gösterir, ancak çoğu çözünürlükte düşük reaksiyon gösterir.
-
Isı Dayanıklılığı: Polimerler, erime noktalarına göre farklılık gösterir.
🔹 5. Polimerlerin Kullanım Alanları
-
Plastikler: Ambalaj malzemeleri, otomobil parçaları, oyuncaklar.
-
Lifler: Giysi, halılar ve kumaşlar.
-
İlaçlar: Polimerler, kontrollü ilaç salınımı için kullanılır.
-
Biyomedikal Alanlar: Dikiş iplikleri, yapay organlar.
🔍 Örnek Soru:
Soru: Aşağıdaki polimerlerden hangisi doğal bir polimerdir?
A) Polietilen
B) Nişasta
C) Polistiren
D) PVC
E) Polipropilen
Çözüm:
Nişasta, doğal bir polimerdir.
Cevap: B
Makromoleküller ve Polimerler
🔹 1. Makromoleküller Nedir?
-
Makromoleküller, genellikle büyük moleküler ağırlığa sahip ve karmaşık yapılar oluşturan bileşiklerdir.
-
Polimerler, proteinler, nükleik asitler gibi makromoleküller, canlılar için çok önemlidir.
-
Makromoleküller, monomerlerin bir araya gelmesiyle oluşan polimer zincirleri ya da büyük moleküllerdir.
🔹 2. Polimerlerin Fiziksel Özellikleri
▪ Sertlik ve Esneklik:
-
Polimerlerin sert ya da esnek olması, monomerin yapısına ve polimerleşme biçimine bağlıdır.
-
Termoplastikler (örneğin, polietilen) ısıtıldığında yumuşar, termosetler ise ısıtıldığında erimez ve sert kalır.
▪ Isı Dayanıklılığı:
-
Polimerlerin erime noktası ve bozulma sıcaklığı farklıdır.
-
Aromatik polimerler genellikle daha yüksek sıcaklıklara dayanıklıdır.
▪ Çözünürlük:
-
Polimerlerin çözünürlük özellikleri, çözünürlükteki grup veya yapı özelliklerine bağlıdır.
-
Polietilen gibi polimerler genellikle çözünmez, ancak bazı küçük polimerler çözücülerle çözünür.
🔹 3. Polimerlerin Kimyasal Özellikleri
▪ Kimyasal Reaktivite:
-
Polimerler, genellikle daha düşük reaktiviteye sahip olan karbon zincirlerinden oluşurlar.
-
Ancak, fonksiyonel gruplar içeren polimerler (örneğin, karboksilik asit grubu içeren) daha reaktif olabilir.
▪ Hidroliz:
-
Esterler gibi bazı polimerler, su ile reaksiyona girerek hidroliz olur ve daha küçük moleküllere dönüşebilir.
🔹 4. Polimerlerin Mekanik Özellikleri
▪ Çekme ve Esneme Dayanıklılığı:
-
Polimerler, uzama ve bükülme gibi mekanik stresleri kaldırabilirler.
-
Esnek polimerler genellikle yüksek gerilme dayanıklılığına sahiptir.
▪ Şekil ve Boyut Değiştirme:
-
Polimerler, basınç ve sıcaklık gibi çevresel faktörlere bağlı olarak şekil değiştirebilirler.
-
Elastomerler (örneğin, kauçuk) çok esnek olup, eski hallerine geri dönebilirler.
🔹 5. Polimerlerin Uygulama Alanları
▪ Endüstriyel Kullanım:
-
Plastikler: Ambalaj malzemeleri, otomobil parçaları, borular, oyuncaklar.
-
Lifler ve Kumaşlar: Giysiler, halılar, temizlik ürünleri.
-
Yapısal Malzemeler: İnşaat malzemeleri, taşıma ve depolama ürünleri.
▪ Biyomedikal Uygulamalar:
-
Biyopolimerler: DNA, RNA, proteinler, polisakaritler gibi moleküller biyolojik süreçlerde yer alır.
-
Medikal cihazlar: Sentetik polimerler, biyolojik uyumlu malzemeler gibi alanlarda kullanılır.
🔍 Örnek Soru:
Soru: Aşağıdaki maddelerden hangisi bir polimer değildir?
A) Polietilen
B) Polistiren
C) Aseton
D) Polipropilen
E) PVC
Çözüm:
Aseton, bir polimer değildir. Diğerleri, polimer sınıfına giren maddelerdir.
Cevap: C
Biyopolimerler
-
Biyopolimerler, doğada bulunan, canlı organizmalar tarafından üretilen büyük moleküllerdir.
-
Proteinler, DNA, RNA, nişasta, selüloz gibi doğal polimerler biyopolimerlerdir.
-
Biyopolimerler, organizmaların yapı taşlarıdır ve genetik bilgiyi taşır.
Petrol ve Doğal Gazdan Elde Edilen Bileşikler
-
Petrol ve doğal gaz, karbon, hidrojen ve azot içeren bileşikler içerir.
-
Alkanlar, alkenler, alkinler, aromatikler bu bileşikler arasında yer alır.
-
Bu bileşikler, enerji üretimi ve kimyasal sanayi için kullanılır.
Organik Kimya ve Çevre
-
Organik bileşikler, çevreye zararlı olabilirler. Örneğin, plastikler doğada çözünemezler ve ekosistemlere zarar verebilirler.
-
Yeşil kimya, çevreye dost ürünler üretmeyi amaçlayan bir alandır.
-
Biyolojik çözünürlük ve geri dönüşüm organik kimyanın çevre dostu uygulamalarıdır.
AYT Organik Kimya Testi
1. Aşağıdakilerden hangisi bir organik bileşiktir?
2. Organik bileşiklerin çoğu hangi bağ türünü içerir?
A) İyonik
B) Kovalent
C) Metalik
D) Hidrojen
E) Koordine
3. Alkinlerin genel formülü nedir?
4. Benzen halkası taşıyan bileşikler hangi sınıfa girer?
A) Alken
B) Alkin
C) Aromatik
D) Ester
E) Amin
5. Etanol hangi fonksiyonel grubu içerir?
A) Aldehit
B) Eter
C) Keton
D) Alkin
E) Alkol
6. ![]() bileşiği aşağıdakilerden hangisidir?
bileşiği aşağıdakilerden hangisidir?
A) Ester
B) Alkol
C) Asit
D) Aldehit
E) Keton
7. Organik bileşiklerin reaksiyon hızları genellikle nasıldır?
A) Çok hızlı
B) Yavaş
C) Patlayıcı
D) Ani
E) Geri dönüşsüz
8. Aşağıdakilerden hangisi anorganik bir bileşiktir?
9. Fonksiyonel grubu –COOH olan bileşik sınıfı hangisidir?
A) Ester
B) Keton
C) Asit
D) Alkol
E) Amin
10. ![]() bileşiği aşağıdaki gruplardan hangisine girer?
bileşiği aşağıdaki gruplardan hangisine girer?
A) Alkol
B) Keton
C) Eter
D) Asit
E) Aldehit
✅ Cevap Anahtarı:
-
C
-
B
-
C
-
C
-
E
-
C
-
B
-
C
-
C
-
C

