İçindekiler
TYT Kimya Atom ve Yapısı Konu Anlatımı
Kimyanın temel yapı taşı olan atom, tüm maddelerin en küçük yapı birimidir. Günümüzde atomun iç yapısı detaylı bir şekilde incelenmiş ve farklı atom modelleri geliştirilmiştir. Atomun yapısını anlamak, kimyasal bağların, elementlerin ve periyodik tablonun çalışma prensiplerini kavramak açısından büyük önem taşır.
Bu ünitede, atomun yapısını, atom teorilerini, atom altı parçacıkları (proton, nötron ve elektron), izotopları ve periyodik sistemin temel prensiplerini öğreneceğiz. Ayrıca, atom modellerinin gelişimiyle kimyanın nasıl bilimsel bir temele oturduğunu inceleyeceğiz.
Atom Modelleri ve Atom Teorilerinin Gelişimi
Atom fikri, antik çağlardan günümüze kadar birçok bilim insanının çalışmalarıyla gelişmiştir. Bilim insanları, atomun yapısını açıklamak için çeşitli atom modelleri geliştirmiştir. Bu modeller, teknolojik gelişmeler ve bilimsel deneyler doğrultusunda zamanla değişmiş ve günümüzdeki modern atom teorisine ulaşılmıştır.
1. Democritus’un Atom Fikri (MÖ 400)
📌 Temel Fikir:
- Democritus’a göre madde, daha küçük parçalara ayrıldığında en küçük, bölünemez bir yapı ortaya çıkar.
- Bu bölünemez yapıya “atomos” adını vermiştir.
- Deneye dayalı bir model değildir, tamamen felsefi bir yaklaşımdır.
⚠ Eksik Yönü:
- Bilimsel yöntem kullanılmadığı için Democritus’un atom fikri kabul görmemiştir.
2. Dalton Atom Modeli (1803)
📌 Temel Fikirler:
- Tüm maddeler atomlardan oluşur.
- Atomlar bölünemez ve yok edilemez.
- Bir elementin tüm atomları aynıdır, farklı elementlerin atomları birbirinden farklıdır.
- Atomlar kimyasal reaksiyonlarla birleşerek bileşikleri oluşturur.
⚠ Eksik Yönleri:
- Atomun iç yapısı hakkında bilgi vermez.
- Atomun parçalanamaz olduğu fikri sonradan çürütülmüştür.
3. Thomson Atom Modeli (1897) – Üzümlü Kek Modeli
📌 Katkıları:
- Elektronun keşfiyle birlikte atomun bölünebilir olduğu anlaşıldı.
- Atom, pozitif yüklü bir küre içinde rastgele dağılmış negatif elektronlardan oluşur.
- Üzümlü kek modeli olarak adlandırılmıştır.
⚠ Eksik Yönleri:
- Atomda pozitif yüklerin ve negatif elektronların nasıl dağıldığını tam olarak açıklayamaz.
- Çekirdek kavramı bu modelde yer almaz.
4. Rutherford Atom Modeli (1911) – Çekirdekli Model
📌 Katkıları:
- Altın Folyo Deneyi sonucunda atomun büyük kısmının boşluk olduğu ortaya kondu.
- Atomun merkezinde pozitif yüklü bir çekirdek bulunur ve elektronlar bu çekirdek etrafında hareket eder.
⚠ Eksik Yönleri:
- Elektronların neden çekirdeğe düşmediği açıklanamamıştır.
- Elektronların hareket düzeni hakkında bilgi vermez.
5. Bohr Atom Modeli (1913) – Yörüngeli Model
📌 Katkıları:
- Elektronlar, çekirdek etrafında belirli yörüngelerde (enerji seviyelerinde) hareket eder.
- Her yörüngenin belirli bir enerji seviyesi vardır.
- Elektronlar, bir enerji seviyesinden diğerine enerji alarak veya yayarak geçebilir.
⚠ Eksik Yönleri:
- Sadece hidrojen atomu için kesin sonuçlar verir, çok elektronlu atomlar için yetersizdir.
6. Modern Atom Teorisi (Kuantum Mekanik Modeli – 1926)
📌 Temel Fikirler:
- Elektronlar belirli yörüngelerde hareket etmez, belirli bir bölgede bulunma olasılığı ile tanımlanır.
- Elektronların bulunma ihtimalinin yüksek olduğu bölgelere “orbital” adı verilir.
- Heisenberg Belirsizlik İlkesi: Elektronun konumu ve hızı aynı anda kesin olarak bilinemez.
🔬 Önemi:
- Günümüzde kabul gören modern atom modeli budur.
- Atom altı parçacıklar daha ayrıntılı olarak incelenmiştir.
Atom modelleri, bilim insanlarının yaptıkları deneyler ve teknolojik gelişmelerle zamanla değişmiş ve gelişmiştir. Günümüzde, elektronların tam olarak belirli bir yörüngede hareket etmediği, ancak belirli bir olasılık dağılımı içinde bulunduğu kabul edilmektedir.
Atomun Yapısı ve Alt Parçacıklar
Atom, proton, nötron ve elektron adı verilen atom altı parçacıklardan oluşur. Bu parçacıklar, atomun temel yapı taşlarıdır ve her biri farklı yük ve kütle özelliklerine sahiptir. Atomun merkezinde çekirdek, çevresinde ise elektron bulutu bulunur.
1. Atomun Temel Parçacıkları
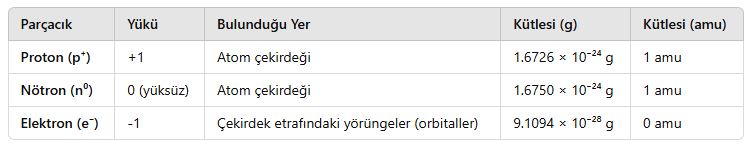
📌 Not: 1 amu (atomik kütle birimi) ≈ 1.66 × 10⁻²⁴ g’dır.
🔹 Protonlar ve nötronlar, atomun çekirdeğinde bulunur ve atomun büyük kısmını oluşturur.
🔹 Elektronlar ise çekirdek etrafındaki enerji seviyelerinde hareket eder.
2. Proton (p⁺)
📌 Özellikleri:
- Atomun pozitif yüklü parçacığıdır.
- Atom numarasını (Z) belirler.
- Kimyasal özellikleri belirleyen temel parçacıktır.
- Elementler, proton sayısına göre sınıflandırılır.
📌 Örnek:
- Hidrojen (H) → 1 proton içerir (Z = 1).
- Oksijen (O) → 8 proton içerir (Z = 8).
🚀 Önemli Bilgi: Bir elementin proton sayısı değişirse, başka bir elemente dönüşür.
3. Nötron (n⁰)
📌 Özellikleri:
- Yüksüz (nötr) parçacıktır.
- Protonlarla birlikte atom çekirdeğinde bulunur.
- Atomun kütlesine katkı sağlar.
📌 Örnek:
- Karbon-12 atomu → 6 proton + 6 nötron içerir.
- Oksijen-16 atomu → 8 proton + 8 nötron içerir.
🚀 Önemli Bilgi: Bir elementin nötron sayısı değişirse, izotop oluşur.
4. Elektron (e⁻)
📌 Özellikleri:
- Atomun negatif yüklü parçacığıdır.
- Çekirdeğin etrafında orbital adı verilen enerji seviyelerinde hareket eder.
- Atomun kimyasal bağ yapmasını sağlar.
📌 Örnek:
- Hidrojen (H) → 1 proton, 1 elektron içerir.
- Karbon (C) → 6 proton, 6 elektron içerir.
🚀 Önemli Bilgi:
- Atom, elektron kaybederse + yüklü iyon (katyon), elektron kazanırsa – yüklü iyon (anyon) oluşur.
- Elektronların çekirdeğe uzaklığı arttıkça enerjisi artar.
5. Atomun Yükü ve İyonlar
🔹 Nötr Atom: Proton sayısı = Elektron sayısı
🔹 Katyon (+ Yüklü İyon): Elektron kaybeden atom
🔹 Anyon (- Yüklü İyon): Elektron kazanan atom
📌 Örnek:
- Na (Sodyum) atomu → 11 proton, 11 elektron (Nötr)
- Na⁺ (Sodyum iyonu) → 11 proton, 10 elektron (Katyon)
- Cl (Klor) atomu → 17 proton, 17 elektron (Nötr)
- Cl⁻ (Klor iyonu) → 17 proton, 18 elektron (Anyon)
🚀 Önemli Bilgi: Atomlar, kararlı hale gelmek için elektron alışverişi yaparak iyonlara dönüşebilirler.
Sonuç:
- Atomun çekirdeğinde proton ve nötron bulunur, elektronlar ise çekirdeğin etrafında hareket eder.
- Atomun kimyasal özelliklerini belirleyen temel faktör proton sayısıdır.
- Nötron sayısı değişirse izotoplar, elektron sayısı değişirse iyonlar oluşur.
İzotop, İzoton ve İzobar Kavramları
Atomların proton, nötron ve elektron sayıları değişebilir. Bu değişimler, atomların farklı özellikler kazanmasına neden olur. İzotop, izoton ve izobar atomlar, elementlerin farklı varyasyonlarını açıklayan kavramlardır.
1. İzotop Atomlar
📌 Tanım:
İzotop atomlar, proton sayısı aynı, ancak nötron sayısı farklı olan atomlardır.
📌 Özellikleri:
- Aynı elementin farklı kütle numarasına sahip türleridir.
- Kimyasal özellikleri aynıdır, fiziksel özellikleri farklıdır.
- Aynı periyodik tablo elementidir.
📌 Örnekler:
-
Hidrojen İzotopları
- Protium (¹H): 1 proton, 0 nötron
- Döteryum (²H): 1 proton, 1 nötron
- Trityum (³H): 1 proton, 2 nötron
-
Karbon İzotopları
- C-12: 6 proton, 6 nötron
- C-13: 6 proton, 7 nötron
- C-14: 6 proton, 8 nötron
🔬 Önemli Bilgi:
- Radyoaktif izotoplar, tıp ve sanayide kullanılır. Örneğin, Karbon-14 (C-14) izotopu arkeolojik yaş tespitinde kullanılır.
- İzotoplar kimyasal olarak aynıdır, çünkü kimyasal özellikler proton ve elektron sayısına bağlıdır.
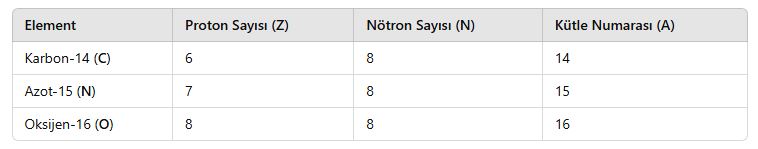
2. İzoton Atomlar
📌 Tanım:
İzoton atomlar, nötron sayısı aynı, ancak proton sayısı farklı olan atomlardır.
📌 Özellikleri:
- Farklı elementlere aittirler.
- Kimyasal ve fiziksel özellikleri farklıdır.
- Nötron sayıları eşittir, ancak atom numaraları farklıdır.
📌 Örnekler:
🚀 Önemli Bilgi:
- İzoton atomlar farklı periyodik elementlerdir.
- Kimyasal özellikleri farklıdır, çünkü proton ve elektron sayıları farklıdır.
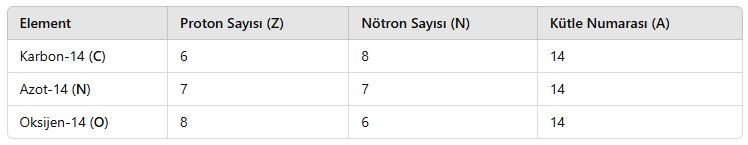
3. İzobar Atomlar
📌 Tanım:
İzobar atomlar, kütle numarası aynı, ancak proton ve nötron sayıları farklı olan atomlardır.
📌 Özellikleri:
- Farklı elementlere aittirler.
- Kimyasal özellikleri farklıdır.
- Kütle numaraları eşittir.
📌 Örnekler:
🚀 Önemli Bilgi:
- İzobar atomlar aynı kütleye sahiptir, ancak farklı elementlerdir.
- Periyodik tabloda farklı yerlerde bulunurlar.
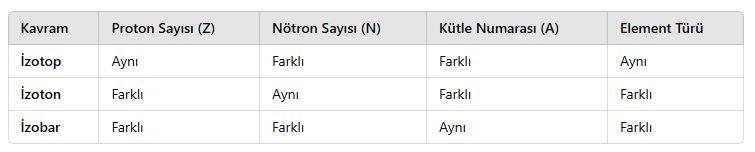
4. Karşılaştırma Tablosu
Sonuç:
- İzotoplar, aynı elementin farklı kütle numaralarına sahip türleridir.
- İzotonlar, farklı elementlerin aynı nötron sayısına sahip türleridir.
- İzobarlar, farklı elementlerin aynı kütle numarasına sahip türleridir.
📌 Özetle:
- İzotop → Aynı element, farklı nötron sayısı
- İzoton → Farklı element, aynı nötron sayısı
- İzobar → Farklı element, aynı kütle numarası
Atomun Elektron Dağılımı ve Kuantum Sayıları
Atomun kimyasal özelliklerini belirleyen en önemli faktörlerden biri elektronların dağılımıdır. Elektronlar belirli enerji seviyelerinde (kabuklar) ve bu seviyelerde bulunan orbitallerde hareket ederler. Kuantum mekaniği ile birlikte elektronların konumu ve enerjisi kuantum sayıları ile açıklanır.
1. Elektron Dağılımı (Enerji Seviyeleri ve Orbitaller)
🔹 Elektronlar çekirdeğe en yakın seviyeden (en düşük enerjili seviyeden) başlayarak yerleşir.
🔹 Her enerji seviyesi belirli sayıda elektron alabilir.
🔹 Elektronlar orbitallerde belirli kurallara göre dizilir.
📌 Başlıca Enerji Seviyeleri ve Elektron Kapasiteleri:
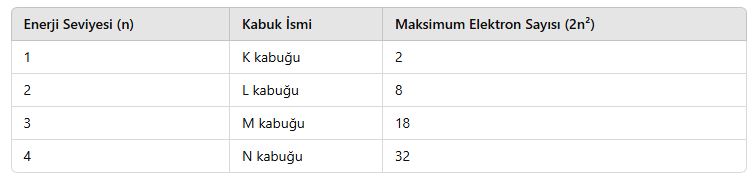
📌 Örnek: Oksijen Atomunun Elektron Dağılımı (Z=8)
-
- enerji seviyesi → 2 elektron
-
- enerji seviyesi → 6 elektron
- Elektron dizilimi: 2, 6
📌 Örnek: Kalsiyum Atomunun Elektron Dağılımı (Z=20)
-
- enerji seviyesi → 2 elektron
-
- enerji seviyesi → 8 elektron
-
- enerji seviyesi → 8 elektron
-
- enerji seviyesi → 2 elektron
- Elektron dizilimi: 2, 8, 8, 2
2. Kuantum Sayıları
Elektronların konumu kuantum sayıları ile belirlenir. Bir elektronu tanımlamak için 4 farklı kuantum sayısı kullanılır:
2.1. Baş Kuantum Sayısı (n)
📌 Tanım:
- Elektronun bulunduğu ana enerji seviyesini (kabukları) belirler.
- n = 1, 2, 3, 4… şeklinde tam sayı değerleri alır.
📌 Örnek:
- Oksijen atomunun ilk yörüngesindeki elektronlar için n = 1
- Oksijen atomunun ikinci yörüngesindeki elektronlar için n = 2
2.2. Açısal Momentum Kuantum Sayısı (ℓ)
📌 Tanım:
- Elektronun bulunduğu orbital türünü belirler.
- Orbitalin şekli ile ilgilidir.
- ℓ 0’dan (n-1)’e kadar tam sayı değerleri alır.
📌 Orbital Türleri ve ℓ Değerleri:
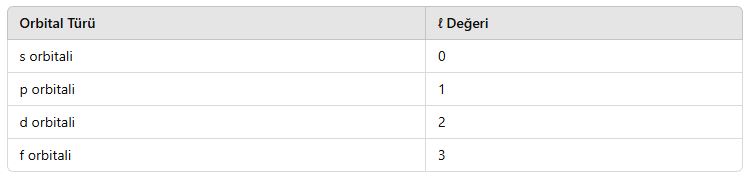
📌 Örnek:
- n = 2 seviyesinde s orbitali için ℓ = 0, p orbitali için ℓ = 1 olabilir.
2.3. Manyetik Kuantum Sayısı (mₗ)
📌 Tanım:
- Elektronun bulunduğu orbitalin yönelimini belirler.
- mₗ, -ℓ ile +ℓ arasında değerler alır.
📌 Orbital Yönelimleri ve mₗ Değerleri:
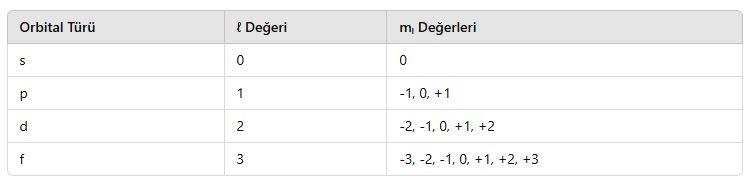
📌 Örnek:
- p orbitali (ℓ = 1) için mₗ = -1, 0, +1 olabilir.
- d orbitali (ℓ = 2) için mₗ = -2, -1, 0, +1, +2 olabilir.
2.4. Spin Kuantum Sayısı (mₛ)
📌 Tanım:
- Elektronun dönme yönünü (spinini) belirler.
- mₛ = +½ veya -½ değerlerini alır.
📌 Örnek:
- Aynı orbitalde bulunan elektronlardan biri +½, diğeri -½ spin değerine sahiptir.
3. Elektronların Dağılımını Belirleyen Kurallar
Elektronların orbitallere nasıl yerleştiği belirli kurallara göre düzenlenir:
🔹 1. Aufbau (Enerji Düzeyleri) İlkesi:
Elektronlar en düşük enerjili orbitalden başlayarak yerleşir.
📌 Elektron Dizilimi Sırası:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p…
🔹 2. Pauli Dışarlama İlkesi:
Bir atomda aynı kuantum sayılarına sahip iki elektron bulunamaz.
📌 Örnek:
Aynı orbitalde en fazla 2 elektron bulunabilir ve spinleri zıt olmalıdır (+½, -½).
🔹 3. Hund Kuralı:
Aynı enerji seviyesindeki orbitaller önce tek tek elektron alır, sonra eşleşir.
📌 Örnek:
- Karbon atomunun 2p orbitalleri:
- ⬆️ ⬆️ ⬆️ (Elektronlar önce tek tek yerleşir)
- ⬆️⬇️ ⬆️ ⬆️ (Sonra eşleşmeye başlar)
Sonuç:
- Elektronlar belirli enerji seviyelerinde (kabuklar) bulunur ve orbitallere yerleşir.
- Bir elektronun konumu ve enerjisi 4 kuantum sayısı ile belirlenir.
- Elektronlar orbitallere belirli kurallara göre yerleşir (Aufbau, Pauli, Hund).
Periyodik Sistem ve Atomun Özellikleri
Periyodik sistem, elementleri atom numaralarına (proton sayısına) göre düzenleyen bir tablodur. Elementler belirli periyot ve gruplara yerleştirilerek kimyasal ve fiziksel özelliklerine göre sınıflandırılmıştır. Bu sistem, elementlerin davranışlarını anlamamızı ve kimyasal tepkimeleri tahmin etmemizi kolaylaştırır.
1. Periyodik Tablonun Tarihçesi
📌 Dmitri Mendeleyev (1869)
- Elementleri atom kütlelerine göre sıraladı.
- Periyodik tablonun temelini attı ve bazı keşfedilmemiş elementleri öngördü.
📌 Henry Moseley (1913)
- Atom numarası kavramını getirdi ve elementleri proton sayılarına göre sıraladı.
- Günümüzde kullanılan modern periyodik sistemin temelini oluşturdu.
2. Modern Periyodik Tablo
2.1. Periyodik Tablonun Yapısı
🔹 7 periyot (yatay sıralar) ve 18 grup (dikey sütun) içerir.
🔹 Elementler, atom numarasına göre artan şekilde sıralanmıştır.
📌 Gruplar ve Periyotlar:
- Periyotlar (Yatay Sıralar):
- Atomun ana enerji seviyesini (kabuk sayısını) gösterir.
- Gruplar (Dikey Sütunlar):
- Benzer kimyasal özelliklere sahip elementleri içerir.
- A grubu (ana gruplar) ve B grubu (geçiş metalleri) olarak ikiye ayrılır.
📌 Özel Gruplar:
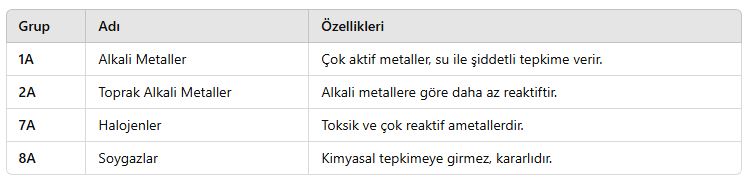
3. Atomun Özellikleri ve Periyodik Değişimleri
Periyodik tabloda atom özellikleri belirli kurallara göre değişir:
3.1. Atom Yarıçapı
📌 Tanım: Atomun büyüklüğünü ifade eder.
📈 Periyodik Tabloya Göre Değişim:
- Aynı grupta aşağı inildikçe atom yarıçapı artar.
- Sebep: Elektron katman sayısı artar.
- Aynı periyotta sağa gidildikçe atom yarıçapı küçülür.
- Sebep: Çekirdek yükü (proton sayısı) artar ve elektronları daha fazla çeker.
📌 Örnek:
- Li (Lityum) > Na (Sodyum) > K (Potasyum)
- K (Potasyum) > Ca (Kalsiyum) > Fe (Demir) > Cl (Klor)
3.2. İyonlaşma Enerjisi
📌 Tanım: Bir atomdan elektron koparmak için gereken enerji miktarıdır.
📈 Periyodik Tabloya Göre Değişim:
- Aynı grupta aşağı inildikçe iyonlaşma enerjisi azalır.
- Sebep: Elektronlar çekirdekten uzaklaşır, koparmak daha kolay olur.
- Aynı periyotta sağa gidildikçe iyonlaşma enerjisi artar.
- Sebep: Çekirdek elektronları daha güçlü çeker.
📌 Örnek:
- Na < Mg < Al < Cl
3.3. Elektronegatiflik
📌 Tanım: Bir atomun bağlı olduğu elektronları çekme gücüdür.
📈 Periyodik Tabloya Göre Değişim:
- Aynı grupta aşağı inildikçe elektronegatiflik azalır.
- Aynı periyotta sağa gidildikçe elektronegatiflik artar.
📌 Örnek:
- Flor (F) en elektronegatif elementtir.
- Metallerin elektronegatifliği düşüktür, ametallerin yüksektir.
3.4. Metalik ve Ametalik Özellik
📌 Metalik Özellik: Metallerin elektron verme eğilimidir.
📌 Ametalik Özellik: Ametallerin elektron alma eğilimidir.
📈 Periyodik Tabloya Göre Değişim:
- Aynı grupta aşağı inildikçe metalik özellik artar, ametalik özellik azalır.
- Aynı periyotta sağa gidildikçe metalik özellik azalır, ametalik özellik artar.
📌 Örnek:
- Metalik özellik: Na (Sodyum) > Al (Alüminyum) > Cl (Klor)
- Ametalik özellik: F (Flor) > O (Oksijen) > N (Azot)
4. Periyodik Sistemde Elementlerin Sınıflandırılması
📌 Metaller:
- Sol tarafta yer alır.
- Elektron vererek katyon (pozitif iyon) oluşturur.
- İyi iletkendir, dövülebilir ve parlaktır.
📌 Ametaller:
- Sağ tarafta yer alır.
- Elektron alarak anyon (negatif iyon) oluşturur.
- Kırılgandır, ısı ve elektriği iyi iletmez.
📌 Yarı Metaller:
- Metal ve ametal özellikleri gösterir.
- Silisyum (Si) en önemli yarı metaldir.
📌 Soygazlar:
- 8A grubundadır.
- Kimyasal olarak kararlıdır, bileşik oluşturmaz.
- Helyum (He), Neon (Ne), Argon (Ar) gibi gazlar bulunur.
Sonuç:
- Periyodik tablo elementleri atom numarasına göre sıralar.
- Atom yarıçapı, iyonlaşma enerjisi, elektronegatiflik ve metalik özellik periyodik olarak değişir.
- Metaller, ametaller, yarı metaller ve soygazlar farklı kimyasal özelliklere sahiptir.
Periyodik Sistem ve Atomun Özellikleri – Ünite Testi
1. Periyodik tablonun gelişiminde hangi bilim insanı elementleri atom numarasına göre sıralamıştır?
A) Mendeleyev
B) Dalton
C) Moseley
D) Thomson
2. Periyodik tabloda aynı periyotta bulunan elementler için aşağıdakilerden hangisi doğrudur?
A) Aynı kimyasal özelliklere sahiptirler.
B) Atom numaraları aynıdır.
C) Aynı grup numarasına sahiptirler.
D) Aynı enerji seviyesine (kabuk sayısına) sahiptirler.
3. Aşağıdaki elementlerden hangisi bir ametaldir?
A) Na
B) Mg
C) Cl
D) Al
4. Periyodik tabloda bir grupta aşağıya inildikçe aşağıdaki özelliklerden hangisi artar?
A) Elektronegatiflik
B) İyonlaşma enerjisi
C) Atom yarıçapı
D) Ametalik özellik
5. 2. periyot 7A grubunda bulunan bir elementin özellikleri ile ilgili aşağıdakilerden hangisi doğrudur?
A) Metalik özellik gösterir.
B) Kararlı bir yapıya sahiptir.
C) Elektron almaya eğilimlidir.
D) Katyon oluşturma eğilimindedir.
6. Aşağıdaki elementlerden hangisi bir geçiş metalidir?
A) K
B) Fe
C) O
D) Cl
7. Aşağıdaki özelliklerden hangisi sağdan sola doğru gidildikçe periyodik tabloda artar?
A) İyonlaşma enerjisi
B) Elektronegatiflik
C) Atom yarıçapı
D) Ametalik özellik
8. Periyodik tabloda en elektronegatif element aşağıdakilerden hangisidir?
A) Oksijen (O)
B) Azot (N)
C) Klor (Cl)
D) Flor (F)
9. Aşağıdaki elementlerden hangisi soygaz grubunda yer alır?
A) Oksijen
B) Neon
C) Klor
D) Karbon
10. Aşağıdaki ifadelerden hangisi doğrudur?
A) Periyodik tabloda aynı grup elementleri benzer kimyasal özellik göstermez.
B) Ametaller, elektron alarak katyon oluşturur.
C) Metalik özellik sağdan sola doğru artar.
D) Soygazlar bileşik oluşturma eğilimindedir.
Cevap Anahtarı
1 – C
2 – D
3 – C
4 – C
5 – C
6 – B
7 – C
8 – D
9 – B
10 – C
