İçindekiler
Kimyasal Hesaplamalar Konu Anlatımı
Kimyasal tepkimelerde maddelerin ne kadar kullanılacağını veya ne kadar ürün oluşacağını hesaplamak, kimyasal hesaplamalar konusunun temelini oluşturur. Mol kavramı, Avogadro sayısı, molar kütle, yüzde verim ve tepkime denklemleri üzerinden hesaplamalar bu ünitenin ana konularıdır.
Bu ünitede şunları ele alacağız:
✅ Mol Kavramı ve Avogadro Sayısı
✅ Kimyasal Formüller ve Molar Kütle
✅ Reaksiyon Denklemleri ve Stokiyometri
✅ Yüzde Verim ve Sınırlayıcı Bileşen Hesaplamaları
Mol Kavramı ve Avogadro Sayısı
Kimyasal hesaplamalar yaparken atom, molekül ve iyonların sayısını belirlemek için mol kavramı kullanılır. Mol, belirli sayıda taneciği içeren madde miktarı birimidir ve kimyasal hesaplamalarda temel bir büyüklüktür.
1. Mol Kavramı Nedir?
📌 Tanım:
- 1 mol, 6,022 × 10²³ tane atom, molekül veya iyon içeren madde miktarıdır.
- Bu sayı, Avogadro Sayısı olarak adlandırılır ve Nₐ ile gösterilir.
📌 Örnek:
✔ 1 mol su (H₂O) → 6,022 × 10²³ H₂O molekülü içerir.
✔ 1 mol oksijen (O₂) → 6,022 × 10²³ O₂ molekülü içerir.
✔ 1 mol NaCl → 6,022 × 10²³ Na⁺ ve 6,022 × 10²³ Cl⁻ iyonu içerir.
2. Avogadro Sayısı ve Kimyasal Hesaplamalar
📌 Avogadro Sayısı (Nₐ):
![]()
📌 Mol Sayısı Formülü:
✔ n = Mol sayısı
✔ N = Tanecik sayısı (atom, molekül, iyon)
✔ Nₐ = Avogadro Sayısı (6,022 × 10²³)
📌 Örnek:
1,2044 × 10²⁴ tane su molekülü kaç moldür?

3. Mol ile Kütle Arasındaki İlişki
📌 Mol Kütlesi:
- 1 mol maddenin gram cinsinden kütlesine mol kütlesi (g/mol) denir.
- Elementler için mol kütlesi, periyodik tablodaki atom kütlesine eşittir.
- Bileşikler için mol kütlesi, elementlerin atom kütlelerinin toplamıdır.
📌 Mol-Kütle Formülü:
✔ n = Mol sayısı (mol)
✔ m = Kütle (g)
✔ M = Mol kütlesi (g/mol)
📌 Örnek:
36 g su (H₂O) kaç moldür?
✔ H₂O’nun mol kütlesi:
![]()
✔ Mol sayısı:

4. Mol ile Hacim Arasındaki İlişki (Gazlar İçin)
📌 Standart Şartlar (STP – 0°C ve 1 atm) altında:
✔ 1 mol gaz = 22,4 L hacim kaplar.
✔ Tüm gazlar için geçerlidir.
📌 Gazların Hacmi Formülü:
![]()
✔ V = Gazın hacmi (L)
✔ n = Mol sayısı (mol)
📌 Örnek:
3 mol O₂ gazı kaç litre hacim kaplar?
![]()
Sonuç:
✔ 1 mol, 6,022 × 10²³ tane tanecik içerir.
✔ Mol sayısı, kütle, hacim ve tanecik sayısı ile hesaplanabilir.
✔ 1 mol gaz, standart şartlarda 22,4 L hacim kaplar.
✔ Mol kavramı kimyasal hesaplamaların temelini oluşturur.
Kimyasal Formüller ve Molar Kütle
Kimyasal formüller, bir bileşiğin hangi elementlerden oluştuğunu ve bu elementlerin atom sayısını gösteren ifadelerdir. Bir bileşiğin molar kütlesi, içerdiği atomların toplam kütlesidir ve g/mol birimiyle ifade edilir.
1. Kimyasal Formüller ve Çeşitleri
📌 1.1. Basit Formül (Empirik Formül):
- Bileşiği oluşturan elementlerin en basit tam sayı oranını gösterir.
- Örnek:
- H₂O → Su
- CH₂O → Glikozun basit formülü (Asıl formülü C₆H₁₂O₆’dır)
📌 1.2. Molekül Formülü:
- Gerçek atom sayılarını gösterir.
- Empirik formülün tam katı olabilir.
- Örnek:
- C₂H₆ → Etilen (Empirik formülü CH₃’dür.)
📌 1.3. Yapı Formülü:
- Atomların bileşik içindeki bağlarını gösterir.
- Örnek:
- H₂O → H—O—H
- CH₄ → (Merkezde C, dört H bağlı)
📌 1.4. İyonik Bileşik Formülleri:
- Metal ve ametal iyonları içerir.
- Örnek:
- NaCl → Sodyum Klorür (Yemek Tuzu)
- CaCO₃ → Kalsiyum Karbonat (Kireç Taşı)
2. Molar Kütle (g/mol) Hesaplamaları
📌 Tanım:
- Bir bileşiğin 1 molünün gram cinsinden kütlesidir.
- Elementlerin atom kütleleri periyodik tablodan alınır.
📌 Formül:
![]()
📌 Örnek 1:
H₂O’nun molar kütlesini hesaplayalım:
![]()
📌 Örnek 2:
CO₂’nin molar kütlesini hesaplayalım:
![]()
📌 Örnek 3:
Ca(OH)₂’nin molar kütlesini hesaplayalım:
![]()
3. Kimyasal Formül ile Mol ve Kütle İlişkisi
📌 Mol-Kütle Formülü:
✔ n = Mol sayısı (mol)
✔ m = Kütle (g)
✔ M = Molar kütle (g/mol)
📌 Örnek:
36 g H₂O kaç moldür?

📌 Örnek:
2 mol CO₂ kaç gramdır?
![]()
Sonuç:
✔ Kimyasal formüller, bileşiklerin atom dağılımını gösterir.
✔ Molar kütle, 1 mol bileşiğin gram cinsinden kütlesidir.
✔ Mol sayısı, kütle ve molar kütle ile hesaplanabilir.
✔ Bu kavramlar kimyasal tepkimelerin hesaplamalarında temel öneme sahiptir.
Reaksiyon Denklemleri ve Stokiyometri
Kimyasal reaksiyonlar, reaktif maddelerin (girenler) ürünlere dönüşmesi ile gerçekleşir. Bu dönüşümü ifade eden reaksiyon denklemleri, kimyasal hesaplamaların temelidir. Stokiyometri, reaksiyonlarda kullanılan ve oluşan madde miktarlarını hesaplamaya yarayan bilim dalıdır.
1. Kimyasal Denklem ve Dengeleme
📌 Kimyasal Denklemler:
✔ Reaksiyona girenler sol tarafa, ürünler sağ tarafa yazılır.
✔ Reaksiyonda atom sayısı korunmalıdır (Kütlenin Korunumu Kanunu).
✔ Denklem dengeleme işlemi katsayılar eklenerek yapılır.
📌 Örnek Reaksiyon:
Yanma Reaksiyonu:
![]()
Bu reaksiyonu dengeleyelim:
![]()
✔ Girip çıkan atom sayıları eşitlendi:
- C: 1 → 1
- H: 4 → 4
- O: 4 → 4
2. Stokiyometri (Reaksiyon Oranları ve Hesaplamalar)
📌 Mol-Mol Oranları:
- Kimyasal denklemde katsayılar, mol oranlarını gösterir.
- Örnek:

- 2 mol H₂, 1 mol O₂ ile tepkimeye girerek 2 mol H₂O oluşturur.
📌 Mol-Kütle Hesapları:
- Mol sayısı → Kütleye çevirme formülü:
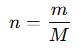
✔ n = Mol sayısı
✔ m = Kütle (g)
✔ M = Molar kütle (g/mol)
📌 Örnek:
4 mol O₂ kaç gramdır?
- O₂’nin molar kütlesi: 32 g/mol
- Toplam kütle:

📌 Örnek:
10 g CH₄ tepkimeye girerse, kaç gram CO₂ oluşur?
✔ CH₄ + 2O₂ → CO₂ + 2H₂O
✔ CH₄’ün molar kütlesi = 16 g/mol
✔ n(CH₄) = 10 / 16 = 0,625 mol
✔ Reaksiyon oranı: 1 mol CH₄ → 1 mol CO₂
✔ CO₂’nin molar kütlesi = 44 g/mol
✔ 0,625 mol CO₂’nin kütlesi:
![]()
3. Sınırlayıcı (Limit Reaktant) ve Artan Madde Hesaplamaları
📌 Sınırlayıcı Bileşen:
- Reaksiyonda ilk biten madde olup, tepkimenin devam etmesini engeller.
📌 Örnek:
2 mol H₂ ile 3 mol O₂ tepkimeye giriyor. Hangisi sınırlayıcıdır?
✔ Reaksiyon:
![]()
✔ Gereken oran: 2H₂ : 1O₂
✔ Mevcut miktarlar: 2 mol H₂, 3 mol O₂
✔ H₂’nin tamamı biter ama O₂’den 1 mol artar.
✔ Sınırlayıcı bileşen H₂’dir.
Sonuç:
✔ Kimyasal denklemler, reaksiyonun matematiksel ifadesidir.
✔ Dengeleme işlemi, atom sayılarının korunmasını sağlar.
✔ Stokiyometri hesapları ile mol ve kütle ilişkisi belirlenir.
✔ Sınırlayıcı madde hesaplanarak tepkimenin hangi maddeden sınırlanacağı bulunur.
Yüzde Verim ve Sınırlayıcı Bileşen Hesaplamaları
Kimyasal tepkimelerde teorik olarak hesaplanan ürün miktarı her zaman elde edilemez. Bunun sebebi yan tepkimeler, deneysel hatalar veya reaksiyonun tamamlanmaması olabilir. Gerçekte elde edilen ürün miktarı, teorik miktara göre yüzde verim hesabı ile belirlenir.
1. Yüzde Verim Nedir?
📌 Tanım:
- Gerçekte elde edilen ürün miktarının, teorik hesaplanan miktara oranıdır.
- %100 verim, tüm reaktantların tam olarak ürünlere dönüştüğünü gösterir.
📌 Yüzde Verim Formülü:

📌 Örnek:
Bir reaksiyonda teorik olarak 50 g ürün beklenirken, 40 g ürün elde edilmiştir.
✔ Yüzde Verim:

2. Sınırlayıcı Bileşen Nedir?
📌 Tanım:
- Tepkimede önce tükenen maddeye sınırlayıcı bileşen denir.
- Sınırlayıcı bileşen bittiğinde reaksiyon durur.
- Ürün miktarı, sınırlayıcı bileşene göre hesaplanır.
📌 Sınırlayıcı Bileşen Belirleme Adımları:
1️⃣ Reaksiyon denklemini yaz ve denkleştir.
2️⃣ Her reaktanın başlangıç mol sayısını belirle.
3️⃣ Reaksiyon katsayılarına göre hangi maddenin önce tükeneceğini bul.
4️⃣ Sınırlayıcı bileşeni kullanarak ürün hesaplaması yap.
📌 Örnek:
4 mol H₂ ve 2 mol O₂, su oluşturmak için reaksiyona giriyor.
![]()
✔ Reaksiyon oranı: 2H₂ : 1O₂
✔ Mevcut miktarlar: 4 mol H₂, 2 mol O₂
✔ Gereken O₂:

✔ H₂ ve O₂ tamamen tükenir, sınırlayıcı bileşen yoktur!
📌 Örnek 2 (Sınırlayıcı Bileşenli):
5 mol H₂ ve 3 mol O₂ ile su üretilecek. Hangisi sınırlayıcı?
![]()
✔ Gereken O₂ miktarı:

✔ Mevcut O₂: 3 mol (yeterli)
✔ H₂ önce biter, yani sınırlayıcı bileşendir.
3. Yüzde Verim ve Sınırlayıcı Bileşen ile Hesaplamalar
📌 Örnek:
10 mol CH₄ ve 15 mol O₂, CO₂ ve H₂O üretmek için tepkimeye giriyor.
![]()
✔ Gereken O₂ miktarı:
![]()
✔ Mevcut O₂: 15 mol (yetersiz, sınırlayıcı O₂)
✔ Tepkime tamamlansa 7,5 mol CH₄ kullanılabilirdi.
✔ Ürün olarak 7,5 mol CO₂ ve 15 mol H₂O oluşur.
📌 Gerçek verim 10 mol CO₂ ise yüzde verimi bulalım:

Bu hesap hatalı, çünkü yüzde verim %100’ü geçemez. Burada ölçüm hatası olabilir.
Sonuç:
✔ Sınırlayıcı bileşen önce tükenen maddedir ve ürün miktarını belirler.
✔ Yüzde verim, teorik ve gerçek ürün miktarlarının karşılaştırılmasıyla hesaplanır.
✔ Gerçek verim her zaman teorik verimden küçük veya eşit olur.
✔ Stokiyometrik hesaplamalar, endüstride malzeme optimizasyonu için kullanılır.
Kimyasal Hesaplamalar Testi
1. 1 mol su (H₂O) kaç tane molekül içerir?
A) 6,022 × 10²²
B) 6,022 × 10²³
C) 3,011 × 10²³
D) 1,2044 × 10²⁴
2. 4 mol O₂ gazı kaç gramdır?
(Atom kütleleri: O = 16 g/mol)
A) 32
B) 64
C) 128
D) 256
3. 2 mol CH₄ (metan) kaç litre hacim kaplar?
(STP’de 1 mol gaz = 22,4 L)
A) 11,2 L
B) 22,4 L
C) 44,8 L
D) 67,2 L
4. Aşağıdaki bileşiklerden hangisinin molar kütlesi en büyüktür?
A) H₂O
B) CO₂
C) NaCl
D) CaCO₃
5. 2H₂ + O₂ → 2H₂O reaksiyonunda 5 mol H₂ ile 3 mol O₂ tepkimeye giriyor. Hangi bileşen sınırlayıcıdır?
A) H₂
B) O₂
C) H₂O
D) Reaksiyon sınırlayıcı içermez.
6. 10 gram NaCl bileşiğinde kaç mol NaCl bulunur?
(Atom kütleleri: Na = 23, Cl = 35,5)
A) 0,10
B) 0,15
C) 0,20
D) 0,25
7. 1 mol CH₄ bileşiğinde kaç tane hidrojen atomu bulunur?
A) 4
B) 6,022 × 10²³
C) 2,409 × 10²⁴
D) 1,204 × 10²⁴
8. Aşağıdaki tepkimelerden hangisinde %100 verim elde edilemez?
A) Na + Cl₂ → NaCl
B) H₂ + O₂ → H₂O
C) C + O₂ → CO₂
D) Reaksiyon ortamına bağlı olarak tümü
9. 20 gram CaCO₃ tam olarak parçalandığında kaç gram CO₂ oluşur?
(Ca = 40, C = 12, O = 16)
A) 8,8 g
B) 11 g
C) 22 g
D) 44 g
10. 80 gram CO₂ elde edilen bir reaksiyonda teorik verim 100 gramdır. Yüzde verim kaçtır?
A) 80%
B) 90%
C) 100%
D) 120%
Cevap Anahtarı
1 – B
2 – C
3 – C
4 – D
5 – B
6 – C
7 – C
8 – D
9 – A
10 – A


