İçindekiler
Madde ve Endüstri / Madde ve Doğası Konu Anlatımı
Madde, kütlesi ve hacmi olan her şeydir. Günlük hayatta karşılaştığımız tüm nesneler, farklı fiziksel ve kimyasal özelliklere sahip maddelerden oluşur. Bu maddeler, periyodik sistemde düzenlenmiş elementlerden meydana gelir. Maddeye uygulanan fiziksel ve kimyasal değişimler, maddenin doğasını ve kullanım alanlarını belirler.
Endüstride kullanılan birçok madde, belirli kimyasal tepkimeler sonucunda elde edilir. Asitler ve bazlar, günlük yaşamda yaygın olarak kullanılırken, maddenin ısı ile etkileşimi, sıcaklık değişimlerinin madde üzerindeki etkisini anlamamızı sağlar. Türkiye’deki kimya endüstrisi, ilaç, plastik, gübre ve boya üretimi gibi pek çok alanda önemli bir yer tutmaktadır.
Bu ünite boyunca, maddenin yapısı ve endüstrideki kullanım alanlarını detaylı bir şekilde inceleyeceğiz.
Periyodik Sistem
Maddelerin temel yapı taşları atomlardır ve her atomun kendine özgü fiziksel ve kimyasal özellikleri vardır. Benzer özelliklere sahip elementleri sınıflandırmak amacıyla Periyodik Tablo oluşturulmuştur. Periyodik sistem, elementlerin atom numaralarına göre düzenlendiği bir tablodur ve Mendeleyev tarafından geliştirilmiştir.
Periyodik Tablonun Yapısı
Periyodik sistemde 118 element bulunmaktadır. Elementler metal, ametal ve soygazlar olarak sınıflandırılır.
📌 Periyodik tablo 7 yatay sıra (periyot) ve 18 dikey sütundan (grup) oluşur.
- Periyot (Yatay Sıra): Atom numarası soldan sağa doğru artar.
- Grup (Dikey Sütun): Benzer kimyasal özelliklere sahip elementler bulunur.
📌 Grupların Özellikleri:
- 1A Grubu (Alkali Metaller): Çok reaktiftir, suyla hızlı tepkimeye girerler.
- 2A Grubu (Toprak Alkali Metaller): Daha az reaktif, doğada bileşik halinde bulunurlar.
- 7A Grubu (Halojenler): Zehirli ve reaktif ametallerdir.
- 8A Grubu (Soygazlar): Kararlı yapıdadır, tepkimeye girmezler.
Element Türleri
📌 Metaller:
✔ Elektrik ve ısıyı iyi iletirler.
✔ Parlak yüzeylidirler.
✔ Tel ve levha haline gelebilirler (şekillendirilebilir).
✔ Oda sıcaklığında çoğu katıdır.
📌 Ametaller:
✔ Genellikle gaz veya katı halde bulunurlar.
✔ Elektrik ve ısıyı iyi iletmezler.
✔ Kırılgandırlar, şekillendirilemezler.
✔ Örnek: Oksijen, karbon, kükürt.
📌 Yarı Metaller:
✔ Hem metal hem ametal özellikleri gösterirler.
✔ Elektronik cihazlarda kullanılırlar.
✔ Örnek: Silisyum (Si), Bor (B).
Periyodik Tablo Nasıl Kullanılır?
- Atom numarası arttıkça elektron sayısı da artar.
- Aynı gruptaki elementler benzer kimyasal özelliklere sahiptir.
- Periyot ilerledikçe metallik özellik azalır, ametalik özellik artar.
📌 Örnek:
- Lityum (Li) ve Sodyum (Na) aynı gruptadır, benzer özellikler gösterir.
- Karbon (C) ve Azot (N) aynı periyotta yer alır, atom numaraları sırayla artar.
Periyodik Tablo ve Günlük Hayat
- Alüminyum (Al): Uçak, mutfak eşyası üretiminde kullanılır.
- Demir (Fe): İnşaat ve makine sanayisinde yaygındır.
- Oksijen (O₂): Solunum için gereklidir.
- Altın (Au): Takı ve elektronik sektöründe kullanılır.
📌 Önemli Bilgi:
Soygazlar (8A grubu) en kararlı elementlerdir ve kimyasal tepkimelere girmezler.
Periyodik Sistem Örnek Soru ve Çözümleri
1. Soru
Periyodik tabloda bir elementin atom numarası arttıkça aşağıdakilerden hangisi değişmez?
A) Proton sayısı
B) Nötron sayısı
C) Elektron sayısı
D) Grup numarası
✅ Cevap: D) Grup numarası
Çözüm: Periyodik tabloda atom numarası arttıkça elektron ve proton sayısı artar, ancak aynı gruptaki elementlerin grup numarası değişmez.
2. Soru
Periyodik tabloda 1A grubunda yer alan elementlerin ortak özelliği nedir?
A) Elektrik akımını iletmezler.
B) Yüksek erime noktalarına sahiptirler.
C) Su ile tepkimeye girerek hidrojen gazı oluştururlar.
D) Gaz halde bulunurlar.
✅ Cevap: C) Su ile tepkimeye girerek hidrojen gazı oluştururlar.
Çözüm: 1A grubu Alkali Metaller suyla hızlı tepkimeye girerek hidrojen gazı açığa çıkarır.
3. Soru
Periyodik tabloda bir element 7A grubunda bulunuyorsa hangi özelliğe sahiptir?
A) Metaliktir.
B) Elektrik ve ısıyı iyi iletir.
C) Halojen grubundadır ve çok reaktiftir.
D) Soygazdır, tepkimeye girmez.
✅ Cevap: C) Halojen grubundadır ve çok reaktiftir.
Çözüm: 7A grubu Halojenler çok reaktif ametallerdir ve kolayca bileşik oluştururlar.
Özet
✔ Periyodik Tablo, elementlerin atom numarasına göre sıralandığı bir sistemdir.
✔ Metaller, ısı ve elektriği iyi iletirken, ametaller kötü iletkenlerdir.
✔ Soygazlar (8A) kararlı olup tepkimeye girmezler.
✔ Aynı gruptaki elementler benzer kimyasal özellik gösterir.
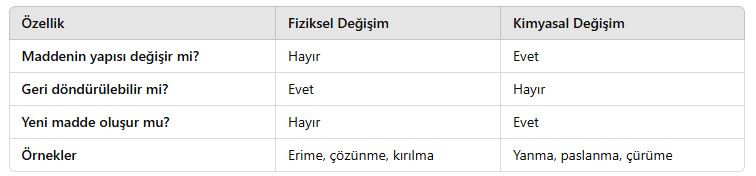
Fiziksel ve Kimyasal Değişimler
Maddeler, çevresel etkenler veya dışarıdan uygulanan işlemler sonucunda değişime uğrayabilir. Bu değişimler fiziksel veya kimyasal olabilir.
✔ Fiziksel değişimlerde maddenin yapısı değişmez, sadece görünüşü değişir.
✔ Kimyasal değişimlerde maddenin yapısı değişir ve yeni bir madde oluşur.
Bu konuyu daha iyi anlamak için fiziksel ve kimyasal değişimlerin özelliklerini ve örneklerini inceleyelim.
Fiziksel Değişim
📌 Fiziksel değişim, maddenin kimyasal yapısının değişmediği, sadece dış görünüşünde farklılık meydana geldiği değişimdir.
✔ Madde aynı kalır, kimliği değişmez.
✔ Genellikle geri döndürülebilir.
✔ Örnek: Su donunca buz olur, ancak tekrar eriyerek suya dönüşebilir.
Fiziksel Değişime Örnekler:
✔ Hâl değişimleri (erime, donma, buharlaşma, yoğuşma, süblimleşme)
✔ Kâğıdın yırtılması
✔ Tuz veya şekerin suda çözünmesi
✔ Metallerin tel veya levha haline getirilmesi
✔ Bir camın kırılması
📌 Örnek:
Buz eridiğinde suya dönüşür, su tekrar donarak buz olabilir. Bu durumda su molekülleri aynı kaldığı için değişim fizikseldir.
Kimyasal Değişim
📌 Kimyasal değişim, maddenin yapısının değiştiği ve yeni bir madde oluştuğu değişimdir.
✔ Geri döndürülemez veya çok zor döndürülür.
✔ Yanma, paslanma, sindirim, çürüme, mayalanma gibi olaylar kimyasal değişimdir.
✔ Tepkime sonucu renk, koku, ısı değişimi veya gaz çıkışı gözlenebilir.
Kimyasal Değişime Örnekler:
✔ Kağıdın yanması
✔ Demirin paslanması
✔ Sütün ekşimesi
✔ Yemeğin pişmesi
✔ Hamurun mayalanması
✔ Fotosentez ve solunum olayları
📌 Kimyasal değişimlerde yeni bir madde oluştuğu için geri döndürmek mümkün değildir. Örneğin: Yanan odun kül olur, ancak külü tekrar odunda çeviremeyiz.
Fiziksel ve Kimyasal Değişim Arasındaki Farklar
Fiziksel ve Kimyasal Değişimler Örnek Soru ve Çözümleri
1. Soru
Aşağıdakilerden hangisi kimyasal değişime örnektir?
A) Buzun erimesi
B) Kağıdın yanması
C) Camın kırılması
D) Şekerin suda çözünmesi
✅ Cevap: B) Kağıdın yanması
Çözüm: Kağıt yandığında kül ve gazlar oluşur, yani yeni maddeler meydana gelir. Bu nedenle kimyasal değişimdir.
2. Soru
Hangi olayda maddenin kimliği değişmemiştir?
A) Yemeğin pişmesi
B) Demirin paslanması
C) Şekerin suda çözünmesi
D) Meyvenin çürümesi
✅ Cevap: C) Şekerin suda çözünmesi
Çözüm: Şeker suda çözündüğünde kimyasal yapısı değişmez, sadece fiziksel olarak dağılır.
3. Soru
Aşağıdaki olaylardan hangisi hem fiziksel hem de kimyasal değişim içerir?
A) Suyun kaynaması
B) Ekmeğin kızarması
C) Tuzun suda çözünmesi
D) Mumun erimesi
✅ Cevap: B) Ekmeğin kızarması
Çözüm: Ekmeğin kızarması sırasında dış yüzeyi yanarak kimyasal değişime uğrar, ancak iç kısmında sadece su kaybı olur ki bu da fiziksel bir değişimdir.
Özet
✔ Fiziksel değişimlerde madde aynı kalır, sadece şekil veya hâl değişir.
✔ Kimyasal değişimlerde ise yeni bir madde oluşur ve geri döndürülemez.
✔ Yanma, çürüme, paslanma gibi olaylar kimyasal değişimdir.
Kimyasal Tepkimeler
Kimyasal tepkimeler, bir veya birden fazla maddenin birleşerek yeni maddeler oluşturduğu dönüşüm süreçleridir. Günlük hayatta nefes almak, yemek pişirmek, metalin paslanması veya yakıtların yanması gibi birçok olay kimyasal tepkimelere örnektir.
✔ Kimyasal tepkimelerde atomlar yeniden düzenlenir ve yeni maddeler oluşur.
✔ Tepkime sonucunda renk değişimi, gaz çıkışı, ısı değişimi veya çökelti oluşumu gözlenebilir.
Kimyasal Tepkime Nedir?
📌 Kimyasal tepkime, atomların bağlarının koparak farklı atomlarla yeniden bağlanması sonucu yeni maddelerin oluşmasıdır.
📌 Kimyasal Tepkime Genel Formülü:
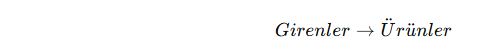
✔ Girenler (Reaktifler): Kimyasal tepkimeye giren maddeler.
✔ Ürünler: Tepkime sonucu oluşan yeni maddeler.
📌 Örnek:
Karbon + Oksijen → Karbondioksit
![]()
✔ Girenler: Karbon (C) ve Oksijen (O₂)
✔ Ürün: Karbondioksit (CO₂)
Kimyasal Tepkime Türleri
🔹 Yanma Tepkimeleri
✔ Bir maddenin oksijenle tepkimeye girerek ısı ve ışık açığa çıkarmasıdır.
✔ Yanma sonucu genellikle CO₂ (karbondioksit) ve H₂O (su) oluşur.
📌 Örnek:
Metan Gazının Yanması:
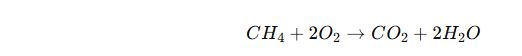
✔ Doğal gazın yanması, mumun yanması, odunun yanması yanma tepkimeleridir.
🔹 Paslanma (Oksitlenme) Tepkimeleri
✔ Metallerin oksijenle yavaş tepkimeye girmesidir.
✔ Pas, demirin oksijen ve su ile birleşmesi sonucu oluşur.
📌 Örnek:
Demirin Paslanması:
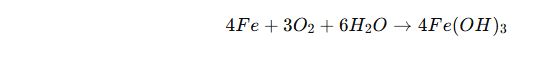
🔹 Asit-Baz Tepkimeleri (Nötralleşme Tepkimeleri)
✔ Asitler ve bazlar birleşerek su ve tuz oluşturur.
📌 Örnek:
Hidroklorik Asit (HCl) + Sodyum Hidroksit (NaOH) → Su (H₂O) + Tuz (NaCl)
![]()
✔ Bu tepkimeler mide asidini nötralize eden ilaçlarda ve temizlik malzemelerinde kullanılır.
Kimyasal Tepkimenin Belirtileri
✔ Renk değişimi → Meyvenin çürümesi, kağıdın yanması
✔ Gaz çıkışı → Şişenin içine sirke ve karbonat koyulduğunda kabarcık oluşması
✔ Çökelti oluşumu → Süt kesildiğinde tortu oluşması
✔ Isı ve ışık açığa çıkması → Mumun yanması
✔ Koku değişimi → Yemeğin bozulması
📌 Önemli Not:
Kimyasal tepkimelerde atom sayısı korunur. Bu ilkeye “Kütlenin Korunumu Kanunu” denir.
Kimyasal Tepkimeler Örnek Soru ve Çözümleri
1. Soru
Bir kimyasal tepkime sonucunda gaz çıkışı gözleniyorsa bu neyin göstergesidir?
A) Fiziksel değişim olduğunu
B) Tepkimenin kimyasal olduğunun
C) Maddenin yalnızca hâl değiştirdiğinin
D) Yeni bir madde oluşmadığının
✅ Cevap: B) Tepkimenin kimyasal olduğunun
Çözüm: Gaz çıkışı, genellikle bir kimyasal değişimin işaretidir. Örneğin, sirke ve karbonatın birleşmesiyle karbondioksit gazı açığa çıkar.
2. Soru
Aşağıdaki tepkimelerden hangisi yanma tepkimesine örnektir?
A) Karbondioksitin suda çözünmesi
B) Demirin paslanması
C) Odunun yanması
D) Suyun buharlaşması
✅ Cevap: C) Odunun yanması
Çözüm: Yanma tepkimeleri oksijenle gerçekleşir ve ısı açığa çıkar. Odunun yanması CO₂ ve su buharı oluşturduğu için bir yanma tepkimesidir.
3. Soru
Bir kimyasal tepkime sırasında ısı açığa çıkıyorsa bu tepkime nasıl adlandırılır?
A) Endotermik
B) Egzotermik
C) Fiziksel
D) Nötralleşme
✅ Cevap: B) Egzotermik
Çözüm: Egzotermik tepkimelerde ısı açığa çıkar. Örneğin, odunun yanması egzotermik bir tepkimedir.
Özet
✔ Kimyasal tepkimeler, atomların yeni düzenlenmesiyle yeni maddelerin oluştuğu reaksiyonlardır.
✔ Yanma, paslanma, nötralleşme tepkimeleri en yaygın kimyasal tepkime türleridir.
✔ Kimyasal değişimler geri döndürülemez ve belirli belirtiler (renk değişimi, gaz çıkışı, ısı açığa çıkması) ile anlaşılır.
Asitler ve Bazlar
Asitler ve bazlar, kimyasal özellikleri farklı olan ve birçok günlük madde içinde bulunan maddelerdir. Örneğin, limon suyu asidik bir maddeyken, sabun bazik bir maddedir.
✔ Asitler ekşi tat verir, bazlar ise acımsıdır.
✔ Asitler mavi turnusol kağıdını kırmızıya çevirir, bazlar ise kırmızı turnusol kağıdını maviye çevirir.
Asitlerin Özellikleri
📌 Asitler, suda çözündüğünde hidrojen iyonu (H⁺) oluşturan maddelerdir.
📌 Tatları ekşidir (Ancak kimyasal maddeler tadılmamalıdır!).
📌 Metallerle tepkimeye girerek hidrojen gazı oluştururlar.
📌 Elektrik akımını iletirler.
📌 pH değerleri 0 ile 7 arasındadır.
Günlük Hayatta Asitler
✔ Hidroklorik Asit (HCl) → Mide asidinde bulunur.
✔ Sitrik Asit → Limon, portakal gibi meyvelerde bulunur.
✔ Asetik Asit → Sirkenin ana maddesidir.
✔ Karbonik Asit → Gazlı içeceklerde bulunur.
📌 Örnek: Limon suyu, sirke, yoğurt ve asitli içecekler asidik maddelerdir.
Bazların Özellikleri
📌 Bazlar, suda çözündüğünde hidroksit iyonu (OH⁻) oluşturan maddelerdir.
📌 Tatları acıdır ve kaygan bir his bırakır.
📌 Yağları parçalama özelliğine sahiptirler.
📌 Elektrik akımını iletirler.
📌 pH değerleri 7 ile 14 arasındadır.
Günlük Hayatta Bazlar
✔ Sodyum Hidroksit (NaOH) → Sabun, deterjan üretiminde kullanılır.
✔ Amonyak (NH₃) → Temizlik malzemelerinde bulunur.
✔ Magnezyum Hidroksit (Mg(OH)₂) → Mide ilaçlarında kullanılır.
📌 Örnek: Sabun, çamaşır suyu, diş macunu ve bazı temizlik maddeleri baziktir.
Asit ve Bazların Ayırt Edilmesi (pH Ölçeği)
✔ Maddelerin asitlik veya bazlık seviyesini ölçmek için pH ölçeği kullanılır.
✔ pH 0-7 → Asidik madde (Ne kadar düşükse o kadar güçlü asittir.)
✔ pH 7 → Nötr madde (Örneğin saf su)
✔ pH 7-14 → Bazik madde (Ne kadar yüksekse o kadar güçlü bazdır.)
📌 Örnek:
- pH = 2 → Güçlü bir asit (Mide asidi)
- pH = 6 → Zayıf bir asit (Yağmur suyu)
- pH = 7 → Nötr (Saf su)
- pH = 9 → Zayıf bir baz (Diş macunu)
- pH = 13 → Güçlü bir baz (Çamaşır suyu)
📌 Turnusol kağıdı, metil oranj ve fenolftalein gibi maddeler asit ve bazları ayırt etmek için kullanılır.
Nötralleşme Tepkimesi (Asit + Baz → Tuz + Su)
✔ Asit ve baz tepkimeye girdiğinde nötrleşme olur ve su ile tuz oluşur.
📌 Örnek:
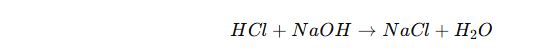
(Hidroklorik Asit + Sodyum Hidroksit → Sofra Tuzu + Su)
✔ Mide asidi fazla olduğunda baz içeren ilaçlar (antiasitler) alınarak nötrleşme sağlanır.
Asitler ve Bazlar Örnek Soru ve Çözümleri
1. Soru
Aşağıdakilerden hangisi asidik bir maddedir?
A) Sabun
B) Çamaşır suyu
C) Limon suyu
D) Diş macunu
✅ Cevap: C) Limon suyu
Çözüm: Limon suyu asidik özellik gösterir ve pH değeri 3 civarındadır.
2. Soru
Bir maddenin pH değeri 9 ise bu madde hakkında ne söylenebilir?
A) Güçlü asittir.
B) Nötrdür.
C) Zayıf bazdır.
D) Güçlü bazdır.
✅ Cevap: C) Zayıf bazdır.
Çözüm: pH değeri 7’nin üzerindeyse madde baziktir. pH değeri 8-10 arasındaki maddeler zayıf bazdır.
3. Soru
Bir laboratuvarda yapılan deneyde bir madde mavi turnusol kağıdını kırmızıya çevirmiştir. Bu madde hakkında aşağıdakilerden hangisi doğrudur?
A) Nötr bir maddedir.
B) Asidiktir.
C) Baziktir.
D) Tuz çözeltisidir.
✅ Cevap: B) Asidiktir.
Çözüm: Asitler mavi turnusol kağıdını kırmızıya çevirir.
4. Soru
Bir asit ile bir baz tepkimeye girdiğinde ne oluşur?
A) Gaz ve tuz
B) Su ve tuz
C) Asit ve metal
D) Alkali madde
✅ Cevap: B) Su ve tuz
Çözüm: Asit + Baz → Su + Tuz şeklinde nötrleşme tepkimesi oluşur.
Özet
✔ Asitler, suda çözündüğünde H⁺ iyonu oluşturur, tatları ekşidir.
✔ Bazlar, suda çözündüğünde OH⁻ iyonu oluşturur, kaygan ve acıdır.
✔ pH değeri 0-7 → Asit, 7 → Nötr, 7-14 → Bazdır.
✔ Asit ve bazlar tepkimeye girerek nötrleşme oluşturur ve su + tuz meydana gelir.
Maddenin Isı ile Etkileşimi
Maddeler, ısı ile etkileşime girdiklerinde sıcaklıkları değişebilir, hâl değiştirebilir veya genleşip büzüşebilir. Günlük hayatta su kaynatmak, buz eritmek veya demiri ısıtmak gibi olaylar maddenin ısı ile etkileşimini gösterir.
Isı ve Sıcaklık Arasındaki Fark
📌 Isı (Q), enerjidir ve Joule (J) veya kalori (cal) ile ölçülür.
📌 Sıcaklık (T), maddenin ortalama tanecik enerjisini gösterir ve Santigrat (°C) veya Kelvin (K) ile ölçülür.
📌 Isı, sıcaklık farkı olan iki madde arasında transfer edilir.
Önemli Farklar:
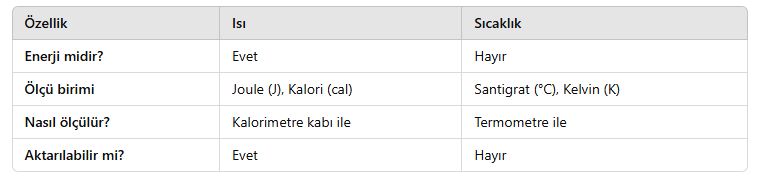
📌 Örnek: Sıcak çay soğuyunca ısı kaybeder, ancak çayın sıcaklığı direkt olarak aktarılmaz.
Isı Alışverişi ve Termal Denge
✔ Sıcaklıkları farklı iki madde temas ettiğinde, ısı yüksek sıcaklıktaki maddeden düşük sıcaklıktaki maddeye geçer.
✔ Isı transferi iki madde aynı sıcaklığa gelene kadar devam eder.
✔ Bu duruma termal denge denir.
📌 Örnek: Sıcak bir kaşık soğuk suya bırakıldığında, kaşık soğur, su ise ısınır ve sonunda aynı sıcaklığa gelir.
Hâl Değişimleri ve Isı
Maddeler, ısı alarak veya vererek hâl değiştirir.
📌 Hâl değişim türleri:

📌 Erime ve buharlaşma ısı alarak gerçekleşirken, donma ve yoğuşma ısı kaybederek gerçekleşir.
✔ Buharlaşma her sıcaklıkta olur, ancak kaynama belirli sıcaklıkta gerçekleşir.
Isı Miktarı ve Özgül Isı
📌 Özgül Isı (c):
✔ 1 gram maddenin sıcaklığını 1°C artırmak için gereken ısı miktarıdır.
✔ Her madde için farklıdır.
📌 Isı Miktarı Formülü:

- Q: Isı miktarı (Joule – J)
- m: Kütle (g veya kg)
- c: Özgül ısı (J/g°C)
- ΔT: Sıcaklık değişimi (°C)
📌 Örnek: Su yüksek özgül ısıya sahiptir, bu yüzden geceleri yavaş soğur, gündüzleri yavaş ısınır.
Isı ve Genleşme
✔ Maddeler ısı aldığında genleşir, ısı kaybettiğinde büzüşür.
✔ Gazlar en fazla genleşen maddelerdir.
📌 Örnek:
- Demiryolu rayları yazın genleştiği için aralarında boşluk bırakılır.
- Cam şişe sıcak suya koyulursa kırılabilir, çünkü genleşme olur.
Maddenin Isı ile Etkileşimi Örnek Soru ve Çözümleri
1. Soru
Aşağıdaki olaylardan hangisi hâl değişimi değildir?
A) Buharlaşma
B) Erime
C) Genleşme
D) Yoğuşma
✅ Cevap: C) Genleşme
Çözüm: Genleşme, maddenin hacminin artmasıdır, ancak hâl değişimi değildir.
2. Soru
Bir su kütlesinin sıcaklığını artırmak için aşağıdakilerden hangisi gereklidir?
A) Kütlesinin azaltılması
B) Isı alması
C) Basıncının artırılması
D) Termal dengeye ulaşması
✅ Cevap: B) Isı alması
Çözüm: Isı alan maddeler sıcaklıklarını artırır.
3. Soru
Aynı miktarda ısı verilen su ve metal için ne söylenebilir?
A) Su daha fazla sıcaklık değişimi gösterir.
B) Metal daha fazla sıcaklık değişimi gösterir.
C) İkisi de aynı sıcaklık değişimine uğrar.
D) Metal soğur, su ısınır.
✅ Cevap: B) Metal daha fazla sıcaklık değişimi gösterir.
Çözüm: Metalin özgül ısısı düşük olduğu için suya göre daha hızlı ısınır.
Özet
✔ Isı ve sıcaklık farklı kavramlardır. Isı enerjidir, sıcaklık ise ölçülebilir bir büyüklüktür.
✔ Maddeler ısı alarak veya vererek hâl değiştirir.
✔ Genleşme, maddelerin ısı ile hacminin artmasıdır.
✔ Özgül ısı her madde için farklıdır ve ısınma miktarını belirler.
Türkiye’de Kimya Endüstrisi
Kimya endüstrisi, günlük yaşamda kullandığımız birçok maddenin üretildiği ve işlendiği bir sektördür. Türkiye’de kimya sanayisi, tarımdan ilaç sanayisine, gıdadan plastik üretimine kadar geniş bir yelpazede faaliyet göstermektedir.
📌 Kimya sanayisi, hammaddeyi işleyerek yeni ve kullanılabilir ürünler elde eden bir sektördür.
Türkiye’de Kimya Endüstrisinin Önemi
✔ Sanayinin gelişmesini sağlar.
✔ İlaç, temizlik malzemeleri, tarım gübreleri gibi temel ihtiyaçları karşılar.
✔ İhracat geliri yüksek olup ekonomiye katkıda bulunur.
✔ Petrokimya, plastik ve boya sanayisinin temelini oluşturur.
📌 Örnek:
- Türkiye’de plastik, deterjan, gübre ve ilaç üretimi kimya sanayisinin önemli bir parçasıdır.
- Petrokimya tesisleri (örneğin PETKİM), plastik ve sentetik elyaf üretiminde önemli rol oynar.
Türkiye’de Kimya Sanayisinin Başlıca Alanları
📌 1️⃣ Petrokimya Sanayi
✔ Petrol ve doğal gazdan plastik, boya, deterjan gibi ürünler üretilir.
✔ Türkiye’de PETKİM (Petrokimya Holding A.Ş.) önemli bir merkezdir.
📌 2️⃣ İlaç Sanayi
✔ Türkiye’de ilaç üretimi ve sağlık sektörü gelişmiştir.
✔ Biyoteknoloji ve kimya mühendisliği ilaç sanayisinde önemli bir yer tutar.
📌 3️⃣ Deterjan ve Temizlik Ürünleri Sanayi
✔ Çamaşır suyu, sabun, şampuan, yüzey temizleyicileri gibi ürünler üretilir.
✔ Türkiye, deterjan üretiminde Avrupa’da önde gelen ülkeler arasındadır.
📌 4️⃣ Boya ve Plastik Sanayi
✔ Türkiye’de plastik ve boya üretimi hızla gelişmiştir.
✔ İnşaat, otomotiv, tekstil sektörleri plastik ve boyaya büyük ihtiyaç duyar.
📌 5️⃣ Tarım Kimyasalları ve Gübre Sanayi
✔ Kimyasal gübreler ve tarım ilaçları, tarımsal üretimi artırmak için kullanılır.
✔ Türkiye’de Toros Tarım, Gübretaş gibi büyük gübre üreticileri bulunmaktadır.
📌 6️⃣ Kozmetik ve Parfüm Sanayi
✔ Kozmetik ürünler (parfüm, şampuan, makyaj malzemeleri) kimya sanayisi ile üretilir.
✔ Türkiye’de bu sektör hızla büyümekte ve ihracat artmaktadır.
Türkiye’de Kimya Endüstrisinin Avantajları ve Zorlukları
📌 Avantajlar:
✔ Ham madde kaynaklarının bulunması (bor mineralleri, soda külü vb.).
✔ Gelişen teknoloji ile üretimin artması.
✔ Stratejik konumu sayesinde ihracat potansiyelinin yüksek olması.
📌 Zorluklar:
❌ Ham madde bağımlılığı: Petrol gibi bazı hammaddeler ithal edilmektedir.
❌ Çevre kirliliği riski: Kimyasal üretim, çevreye zarar verebilir.
❌ Yatırım maliyetlerinin yüksek olması.
📌 Örnek: Türkiye’de plastik, ilaç, gübre ve temizlik ürünleri üretimi güçlüdür, ancak petrol gibi bazı hammaddeleri ithal etmek zorundadır.
Çevre ve Kimya Endüstrisi
✔ Kimya sanayisi bazı çevresel riskler taşıdığı için atık yönetimi ve sürdürülebilir üretim önemlidir.
✔ Yeşil kimya, çevre dostu kimyasal üretim yöntemlerini geliştirmeyi hedefler.
📌 Örnek:
- Geri dönüşümlü plastik üretimi, çevre kirliliğini azaltmak için kimya sanayisinde uygulanmaktadır.
- Biyobozunur (çevrede çözünebilen) plastikler, doğaya zarar vermeyen bir alternatiftir.
Türkiye’de Kimya Endüstrisi Örnek Soru ve Çözümleri
1. Soru
Aşağıdaki sanayi kollarından hangisi kimya endüstrisinin bir parçası değildir?
A) İlaç sanayi
B) Plastik üretimi
C) Çimento sanayi
D) Petrokimya sanayi
✅ Cevap: C) Çimento sanayi
Çözüm: Çimento üretimi, inşaat sektörüne ait bir sanayi koludur. Kimya endüstrisi, ilaç, plastik ve petrokimya gibi alanlarla ilgilenir.
2. Soru
Aşağıdakilerden hangisi Türkiye’de yaygın olan kimya sanayi alanlarından biridir?
A) Çelik üretimi
B) Deterjan ve temizlik ürünleri
C) Mobilya üretimi
D) Elektronik eşya üretimi
✅ Cevap: B) Deterjan ve temizlik ürünleri
Çözüm: Türkiye, deterjan ve temizlik malzemeleri üretiminde Avrupa’da önemli bir yere sahiptir.
3. Soru
Hangi kimyasal madde petrokimya sanayisinde yaygın olarak kullanılır?
A) NaCl (Tuz)
B) H₂O (Su)
C) C₈H₁₈ (Oktan – Benzin)
D) CaCO₃ (Kireç taşı)
✅ Cevap: C) C₈H₁₈ (Oktan – Benzin)
Çözüm: Petrokimya sanayisi, petrol türevlerinden plastik, boya, yakıt gibi maddeleri üretir. Oktan (C₈H₁₈), benzinin temel bileşenidir.
Özet
✔ Türkiye’de kimya endüstrisi gelişmiş olup, ilaç, deterjan, petrokimya ve tarım kimyasalları üretimi yaygındır.
✔ Kimya sanayisi ekonomiye katkı sağlar, ancak çevresel etkileri minimize etmek için önlemler alınmalıdır.
✔ Türkiye’de PETKİM, Gübretaş, Toros Tarım gibi büyük firmalar kimya endüstrisinde faaliyet göstermektedir.
Madde ve Endüstri / Madde ve Doğası – 10 Soruluk Ünite Testi
1. Soru
Aşağıdakilerden hangisi periyodik tablodaki element gruplarından biri değildir?
A) Alkali metaller
B) Halojenler
C) Soygazlar
D) Organik bileşikler
2. Soru
Aşağıdaki olaylardan hangisi kimyasal değişim örneğidir?
A) Suyun buharlaşması
B) Şekerin suda çözünmesi
C) Demirin paslanması
D) Camın kırılması
3. Soru
Bir kimyasal tepkime sonucunda su ve tuz oluşuyorsa bu tepkime hangi tür tepkimedir?
A) Yanma
B) Nötralleşme
C) Oksitlenme
D) Çözünme
4. Soru
Aşağıdakilerden hangisi bir bazın özelliğidir?
A) Tatları ekşidir.
B) Kırmızı turnusol kağıdını maviye çevirirler.
C) pH değeri 0 ile 7 arasındadır.
D) Metallerle tepkimeye girerek hidrojen gazı oluştururlar.
5. Soru
Aşağıdakilerden hangisi bir kimyasal tepkimenin gerçekleştiğini gösteren belirtilerden biri değildir?
A) Renk değişimi
B) Gaz çıkışı
C) Maddenin çözünmesi
D) Isı açığa çıkması
6. Soru
Bir madde ısı aldığında hangi değişim meydana gelir?
A) Donma
B) Yoğuşma
C) Erime
D) Kırağılaşma
7. Soru
Türkiye’de kimya endüstrisinin gelişmesine katkı sağlayan alanlardan biri aşağıdakilerden hangisidir?
A) Plastik ve boya üretimi
B) Elektronik cihaz üretimi
C) Tarım makineleri üretimi
D) Otomobil üretimi
8. Soru
Aşağıdakilerden hangisi Türkiye’de faaliyet gösteren bir petrokimya şirketidir?
A) PETKİM
B) TÜPRAŞ
C) ASELSAN
D) ROKETSAN
9. Soru
Aşağıdaki sanayi kollarından hangisi kimya sanayisinin bir parçasıdır?
A) Çimento üretimi
B) Tekstil sanayi
C) Deterjan üretimi
D) Mobilya üretimi
10. Soru
Yeşil kimya kavramı aşağıdakilerden hangisi ile ilgilidir?
A) Çevre dostu kimyasal üretim
B) Tarımsal kimyasalların artırılması
C) Plastik kullanımının yaygınlaştırılması
D) Enerji üretiminde kimyasal maddelerin azaltılması
Cevap Anahtarı
- D) Organik bileşikler
- C) Demirin paslanması
- B) Nötralleşme
- B) Kırmızı turnusol kağıdını maviye çevirirler.
- C) Maddenin çözünmesi
- C) Erime
- A) Plastik ve boya üretimi
- A) PETKİM
- C) Deterjan üretimi
- A) Çevre dostu kimyasal üretim

