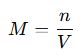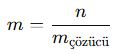İçindekiler
TYT Kimya Karışımlar Konu Anlatımı
Doğada bulunan maddeler saf maddeler ve karışımlar olmak üzere ikiye ayrılır. Saf maddeler belirli bir kimyasal formüle sahip olup, sabit erime ve kaynama noktalarına sahiptir. Karışımlar ise iki veya daha fazla saf maddenin kimyasal bağ yapmadan bir araya gelmesiyle oluşur ve bileşenleri fiziksel yöntemlerle ayrılabilir.
Karışımlar günlük yaşamda yaygın olarak karşımıza çıkar. Hava, farklı gazların bir araya gelmesiyle oluşan bir karışımdır. Deniz suyu, tuz ve suyun birleşmesiyle meydana gelir. Çay, kahve, beton, toprak ve alaşımlar da çeşitli karışımlara örnek olarak verilebilir.
Bu ünitede, karışımların tanımı ve özellikleri, homojen ve heterojen karışımların farkları, karışımların ayrıştırılma yöntemleri ve çözeltilerle ilgili temel hesaplamalar ele alınacaktır.
Bu ünitede şunları ele alacağız:
✅ Karışımların Tanımı ve Özellikleri
✅ Homojen ve Heterojen Karışımlar
✅ Karışımların Ayrıştırılması Yöntemleri
✅ Çözeltiler ve Derişim Hesaplamaları
Karışımlar ve Özellikleri
Karışımlar, iki veya daha fazla saf maddenin kimyasal bağ oluşturmadan bir araya gelmesiyle oluşan sistemlerdir. Bileşenler kimyasal özelliklerini korur ve fiziksel yöntemlerle ayrılabilirler.
1. Karışımların Genel Özellikleri
✔ Bileşenleri fiziksel yöntemlerle ayrıştırılabilir.
✔ Belli bir kimyasal formüle sahip değildirler.
✔ Bileşenler arasında belirli bir oran bulunmaz.
✔ Kimyasal tepkime gerçekleşmez, sadece fiziksel bir birleşim olur.
✔ Saf madde değillerdir, çünkü farklı bileşenlerden oluşurlar.
📌 Örnekler:
- Hava (Azot, oksijen, karbondioksit vb.)
- Tuzlu su (Su + Tuz)
- Meyve suyu (Su + Şeker + Meyve özü)
- Alaşım (Bakır + Çinko = Pirinç)
2. Karışımların Bileşenleri Arasındaki Etkileşim
Karışımların oluşumunda kimyasal bağ bulunmaz. Ancak bileşenlerin tanecik büyüklükleri ve çözünebilirlikleri gibi faktörler, karışımın türünü belirler.
📌 Örnek:
- Şeker ve su karıştığında şeker çözünerek suyun içinde dağılır.
- Zeytinyağı ve su karıştığında ise iki sıvı birbirine karışmaz ve ayrı fazlar oluşturur.
Bu farklılıklar, karışımların homojen veya heterojen olup olmadığını belirler.
3. Karışımların Çeşitleri
📌 Homojen Karışımlar (Çözeltiler):
- Bileşenleri tek bir faz oluşturacak şekilde dağılmıştır.
- Her yerinde aynı özellik gösterir.
- Gözle veya mikroskopla bile ayırt edilemez.
✔ Örnekler:
- Şekerli su
- Tuzlu su
- Hava
- Metal alaşımlar (Çelik, bronz, pirinç vb.)
📌 Heterojen Karışımlar:
- Bileşenleri gözle veya mikroskopla ayırt edilebilir.
- Karışımın her yerinde aynı özellik gözlenmez.
- Katı, sıvı ve gaz fazlarında bulunabilirler.
✔ Örnekler:
- Süt (Kolloid) → Mikroskobik seviyede heterojen
- Zeytinyağı ve su (Emülsiyon)
- Kum ve su (Süspansiyon)
4. Karışımların Kullanım Alanları
✔ Endüstride: Alaşımlar (çelik, lehim, bronz) farklı sektörlerde kullanılır.
✔ Sağlık Sektöründe: Serumlar ve tıbbi çözeltiler.
✔ Gıda Sanayisinde: Meyve suları, süt ve gazlı içecekler.
✔ Günlük Hayatta: Hava, toprak, içme suyu gibi doğal karışımlar.
Sonuç:
✔ Karışımlar, iki veya daha fazla maddenin fiziksel olarak bir araya gelmesiyle oluşur.
✔ Homojen ve heterojen olmak üzere ikiye ayrılır.
✔ Günlük yaşamda ve sanayide geniş kullanım alanına sahiptir.
✔ Bileşenleri fiziksel yöntemlerle ayrılabilir.
Homojen ve Heterojen Karışımlar
Karışımlar, bileşenlerinin dağılımına göre homojen ve heterojen olarak ikiye ayrılır. Gözle veya mikroskopla incelendiğinde bileşenleri ayırt edilemeyen karışımlar homojen, bileşenleri belirgin şekilde farklı fazlarda bulunan karışımlar ise heterojen olarak sınıflandırılır.
1. Homojen Karışımlar (Çözeltiler)
📌 Tanım:
- Tek bir fazdan oluşur ve her noktasında aynı özelliği gösterir.
- Bileşenleri gözle veya mikroskopla ayırt edilemez.
- Genellikle bir çözücü (solvent) ve çözünen (solüt) içerir.
📌 Örnekler:
✔ Tuzlu su (NaCl + H₂O)
✔ Şekerli su (C₁₂H₂₂O₁₁ + H₂O)
✔ Hava (Azot, oksijen, karbondioksit vb.)
✔ Alkol-su karışımı
✔ Metal alaşımlar (Çelik, bronz, pirinç vb.)
📌 Homojen Karışımların Özellikleri:
✔ Çözücü ve çözünen tanecikler moleküler düzeyde dağılmıştır.
✔ Belirli bir çözünürlük sınırına sahiptirler.
✔ Görünüm olarak tek bir madde gibi davranırlar.
✔ Ayrıştırmak için genellikle damıtma, kristallendirme veya kromatografi yöntemleri kullanılır.
2. Heterojen Karışımlar
📌 Tanım:
- Birden fazla faz içerir ve her bölgesinde farklı özellikler gösterir.
- Bileşenleri gözle veya mikroskopla ayırt edilebilir.
📌 Heterojen Karışım Türleri:
A. Süspansiyonlar
- Büyük katı taneciklerin sıvı içinde askıda kaldığı karışımlardır.
- Bir süre bekletildiğinde bileşenler ayrışır.
- Filtrasyon yöntemiyle ayrılabilirler.
✔ Örnekler: Çamurlu su, tebeşir tozu ve su, unlu su.
B. Emülsiyonlar
- Birbiriyle karışmayan iki sıvının birleşmesiyle oluşur.
- Karışımın kararlı hale gelmesi için emülgatör maddeler eklenir.
✔ Örnekler: Süt, zeytinyağı-su karışımı, mayonez.
C. Aerosoller
- Katı veya sıvı taneciklerin bir gaz içinde dağılmasıyla oluşur.
✔ Örnekler: Sis, deodorant, sprey boyalar.
D. Kolloidler
- Süspansiyonlardan daha küçük tanecikler içerir.
- Homojen gibi görünebilirler, ancak ışık saçılımıyla heterojen oldukları anlaşılır (Tyndall etkisi).
✔ Örnekler: Jöle, boya, duman, süt.
3. Homojen ve Heterojen Karışımların Karşılaştırılması
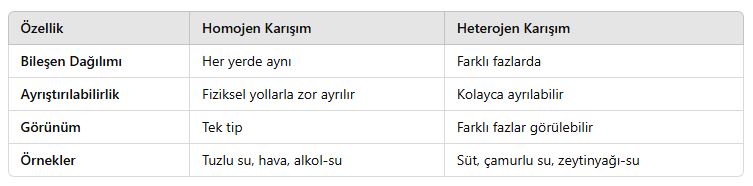
4. Günlük Hayatta Homojen ve Heterojen Karışımlar
✔ Gıda sektöründe: Mayonez (emülsiyon), süt (kolloid).
✔ İlaç sektöründe: Şurup (süspansiyon), serumlar (çözelti).
✔ Sanayide: Metal alaşımlar (homojen), boya ve köpükler (heterojen).
Sonuç:
✔ Homojen karışımlar tek fazlı olup her yerinde aynı özelliği gösterirken, heterojen karışımlar farklı fazlara sahiptir ve gözle ayırt edilebilir.
✔ Süspansiyon, emülsiyon, aerosol ve kolloid gibi heterojen karışım türleri farklı fiziksel özellikler gösterir.
✔ Günlük hayatta birçok homojen ve heterojen karışım kullanılmaktadır.
Karışımların Ayrıştırılması Yöntemleri
Karışımlar, bileşenleri kimyasal bağ yapmadan bir araya geldiği için fiziksel yöntemlerle ayrılabilirler. Ayrıştırma yöntemi, karışımın türüne, bileşenlerin tanecik boyutuna ve çözünürlüğüne bağlı olarak değişir.
1. Fiziksel Yöntemler ile Karışımların Ayrılması
📌 1.1. Süzme (Filtrasyon)
- Katı-sıvı heterojen karışımlarını ayırmak için kullanılır.
- Katı madde filtre kağıdında kalırken, sıvı süzülerek ayrılır.
✔ Örnekler: Çamurlu suyun süzülmesi, çay yapımında çayın posasının ayrılması.
📌 1.2. Mıknatısla Ayırma
- Manyetik özellik gösteren metallerin ayrılmasını sağlar.
✔ Örnekler: Demir tozu ile kum karışımı.
📌 1.3. Eleme (Elek ile Ayırma)
- Farklı büyüklükteki katı taneciklerini ayırmak için kullanılır.
✔ Örnekler: Unun elenmesi, kum ve çakılın ayrılması.
📌 1.4. Yüzdürme (Flotasyon)
- Yoğunluk farkı ile bileşenleri ayırma yöntemidir.
✔ Örnekler: Maden cevherlerinden saf metalin ayrılması.
2. Buharlaştırma ve Damıtma Yöntemleri
📌 2.1. Buharlaştırma
- Çözünen sıvı uçurularak katı madde ayrılır.
✔ Örnekler: Tuzlu suyun buharlaştırılarak tuzun elde edilmesi.
📌 2.2. Basit Damıtma (Distilasyon)
- Kaynama noktası farkı olan sıvılar ayrılır.
✔ Örnekler: Su ve alkolün ayrılması, deniz suyundan içme suyu elde edilmesi.
📌 2.3. Ayrımsal Damıtma
- Farklı kaynama noktalarına sahip gaz ve sıvılar ayrılır.
✔ Örnekler: Ham petrolün fraksiyonlu damıtılması, hava gazlarının ayrılması.
3. Çöktürme ve Ekstraksiyon Yöntemleri
📌 3.1. Çöktürme
- Çözeltideki iyonları çöktürerek ayrıştırma yöntemidir.
✔ Örnekler: Kireçli suya CO₂ gazı verilerek CaCO₃ çöktürülmesi.
📌 3.2. Ekstraksiyon (Çözücü ile Ayırma)
- Maddelerin farklı çözücülerde çözünme farkına dayanır.
✔ Örnekler: Çay yapımında suyun çay yapraklarından özü alması.
4. Karışım Türlerine Göre Kullanılan Ayırma Yöntemleri
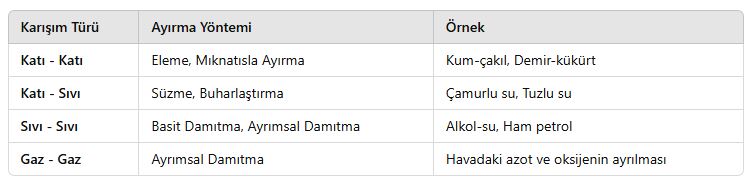
5. Günlük Hayatta Karışımların Ayrılması
✔ Deniz suyundan tuz eldesi (Buharlaştırma)
✔ Ham petrolden benzin üretimi (Ayrımsal damıtma)
✔ Madencilikte cevher ayrıştırma (Flotasyon)
✔ Atık su arıtma tesislerinde çöktürme işlemleri
Sonuç:
✔ Karışımlar, fiziksel yöntemlerle ayrılabilir.
✔ Ayrıştırma yöntemi, bileşenlerin fiziksel özelliklerine bağlıdır.
✔ Bu teknikler sanayi, sağlık ve günlük yaşamda yaygın olarak kullanılır.
Karışımların Ayrıştırılması Yöntemleri
Karışımları bileşenlerine ayırmak için fiziksel yöntemler kullanılır. Ayrıştırma yöntemi, karışımın türü, bileşenlerin çözünürlüğü, yoğunluk farkı ve tanecik boyutuna bağlı olarak değişir.
1. Fiziksel Yöntemler ile Karışımların Ayrılması
📌 1.1. Süzme (Filtrasyon)
✔ Katı-sıvı heterojen karışımlarını ayırmak için kullanılır.
✔ Sıvı süzgeçten geçerken katı madde tutulur.
Örnek:
- Çay yapraklarını çaydan ayırmak
- Çamurlu suyun süzülmesi
📌 1.2. Mıknatıs ile Ayırma
✔ Manyetik özelliği olan metalleri ayırmak için kullanılır.
✔ Demir, nikel, kobalt gibi metaller bu yöntemle ayrılabilir.
Örnek:
- Demir tozu ile kükürt karışımını ayırmak
- Geri dönüşümde metal ayrıştırmak
📌 1.3. Eleme (Elek ile Ayırma)
✔ Farklı boyuttaki katı tanecikleri ayırmada kullanılır.
Örnek:
- Kum ile çakıl taşlarını ayırmak
- Unun elenmesi
📌 1.4. Yoğunluk Farkı ile Ayırma (Çöktürme ve Dekantasyon)
✔ Bir maddenin diğerinden daha yoğun olması durumunda kullanılır.
✔ Yoğunluğu fazla olan madde dibe çöker ve üstteki sıvı başka bir kaba aktarılır.
Örnek:
- Kumlu suyun çökmesini bekleyerek ayrılması
- Yağ ve suyun ayrılması
📌 1.5. Buharlaştırma ve Kristallendirme
✔ Sıvının buharlaştırılmasıyla çözünen katının ayrılmasıdır.
✔ Tuzlu suyun buharlaştırılmasıyla tuz elde edilir.
Örnek:
- Deniz suyundan tuz elde etmek
- Şekerli sudan şekerin kristalleşerek ayrılması
📌 1.6. Damıtma (Distilasyon)
✔ Sıvı-sıvı homojen karışımları bileşenlerinin farklı kaynama noktalarına göre ayırmak için kullanılır.
Örnek:
- Alkol ve suyun ayrılması
- Ham petrolden benzin elde etmek
📌 1.7. Ekstraksiyon (Çözücü ile Ayırma)
✔ Maddelerin çözünürlük farkı kullanılarak ayrılmasıdır.
Örnek:
- Çay yapraklarından çayın özütlenmesi
- Yağlı tohumlardan yağ elde etmek
📌 1.8. Santrifüjleme
✔ Dönme hareketiyle yoğunluğu farklı olan maddelerin ayrılmasını sağlar.
Örnek:
- Kandaki plazmanın ayrılması
- Süt ve kaymağın ayrılması
2. Günlük Hayatta Karışımların Ayrılması
✔ Su arıtma tesislerinde süzme yöntemi kullanılır.
✔ Petrol rafinerilerinde damıtma ile benzin, dizel ve gaz ayrıştırılır.
✔ Gıda endüstrisinde ekstraksiyon ile kahve ve çay özütlenir.
✔ Altın madenciliğinde yoğunluk farkı kullanılarak değerli metaller ayrıştırılır.
Sonuç:
✔ Karışımlar, fiziksel yöntemlerle bileşenlerine ayrılabilir.
✔ Ayrıştırma yöntemi, karışımın türüne göre seçilir.
✔ Süzme, damıtma, buharlaştırma, ekstraksiyon gibi yöntemler sanayi ve günlük yaşamda yaygın olarak kullanılır.
Çözeltiler ve Derişim Hesaplamaları
Çözeltiler, bir maddenin (çözünen) başka bir madde içinde (çözücü) homojen olarak dağılmasıyla oluşan karışımlardır. Tuzlu su, şekerli su, gazlı içecekler ve hava çözeltilere örnektir. Çözeltilerin özelliklerini belirleyen en önemli faktörlerden biri derişim (konsantrasyon) olup, çözünen maddenin çözelti içindeki miktarını ifade eder.
1. Çözeltinin Temel Kavramları
📌 Çözücü (Solvent): Çözeltiyi oluşturan ve genellikle fazla miktarda bulunan bileşendir.
📌 Çözünen (Solüt): Çözücü içinde çözünen maddedir.
📌 Derişim (Konsantrasyon): Çözünen maddenin çözelti içindeki miktarını ifade eder.
📌 Doygunluk: Bir çözücü belirli bir sıcaklıkta maksimum miktarda çözünen maddeyi çözebildiğinde doygun çözelti oluşur.
📌 Seyreltik ve Derişik Çözelti: Az miktarda çözünen içeren çözelti seyreltik, fazla miktarda çözünen içeren çözelti derişik olarak adlandırılır.
2. Derişim Hesaplamaları
Çözelti derişimi farklı yollarla ifade edilebilir:
A. Kütlece Yüzde Derişim (% m/m)

✔ Örnek: 100 g su içinde 20 g tuz çözülmüşse, çözeltinin kütlece yüzde derişimi:
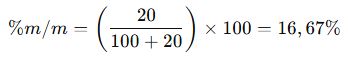
B. Hacimce Yüzde Derişim (% V/V)
Sıvı-sıvı çözeltiler için kullanılır.
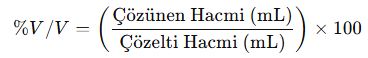
✔ Örnek: 200 mL alkol içinde 50 mL su çözünmüşse, çözeltinin hacimce yüzde derişimi:
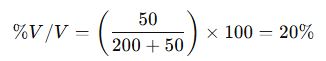
C. Molarite (M)
✔ n = Mol sayısı (mol)
✔ V = Çözelti hacmi (L)
📌 Örnek: 0,5 mol NaCl, 1 L çözeltide çözünmüşse:
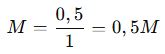
D. Molalite (m)
✔ n = Mol sayısı (mol)
✔ m = Çözücü kütlesi (kg)
📌 Örnek: 2 mol glikoz, 0,5 kg su içinde çözünmüşse:
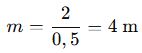
3. Çözeltilerin Günlük Hayatta Kullanımı
✔ Serumlar ve ilaç çözeltileri (% m/m veya Molarite hesaplanarak hazırlanır).
✔ Gübre, temizlik malzemeleri ve içeceklerin hazırlanması için derişim hesaplamaları kullanılır.
✔ Kullanım alanına bağlı olarak çözeltiler seyreltilebilir veya deriştirilebilir.
Sonuç:
✔ Çözeltiler homojen karışımlardır ve çözücü-çözünen ilişkisi ile oluşur.
✔ Derişim hesaplamaları, çözünen maddenin çözelti içindeki oranını belirlemek için kullanılır.
✔ Kimya, tıp, endüstri ve günlük hayatta çözelti derişimleri önemlidir.
Karışımlar Testi
1. Aşağıdakilerden hangisi bir homojen karışımdır?
A) Kum ve su
B) Şekerli su
C) Zeytinyağı ve su
D) Duman
2. Aşağıdaki ayrıştırma yöntemlerinden hangisi süspansiyon karışımları için uygundur?
A) Damıtma
B) Süzme
C) Mıknatısla ayırma
D) Buharlaştırma
3. Gaz-gaz karışımına örnek olarak aşağıdakilerden hangisi verilebilir?
A) Deniz suyu
B) Hava
C) Çamurlu su
D) Tuzlu su
4. Alkol ve suyun birbirinden ayrılması için hangi yöntem kullanılır?
A) Filtrasyon
B) Damıtma
C) Süzme
D) Çöktürme
5. Aşağıdaki karışımlardan hangisi heterojen bir karışımdır?
A) Şekerli su
B) Hava
C) Süt
D) Tuzlu su
6. Bir çözeltiyi oluşturan bileşenlerden çözünenin kütlesi 25 g, çözücünün kütlesi 75 g ise çözelti derişimi yüzde kaçtır?
A) 20%
B) 25%
C) 30%
D) 33%
7. 2 mol NaCl içeren 500 mL çözeltinin molaritesi kaçtır?
A) 0,5 M
B) 1 M
C) 2 M
D) 4 M
8. Aşağıdaki ayrıştırma yöntemlerinden hangisi heterojen karışımları ayırmak için kullanılmaz?
A) Filtrasyon
B) Dekantasyon
C) Damıtma
D) Eleme
9. Tuzlu suyun tuzunu geri kazanmak için hangi yöntem kullanılabilir?
A) Süzme
B) Damıtma
C) Buharlaştırma
D) Mıknatısla ayırma
10. 3 mol H₂SO₄, 1,5 L çözeltide çözünmüşse çözeltinin molaritesi kaçtır?
A) 0,5 M
B) 1 M
C) 2 M
D) 3 M
Cevap Anahtarı
1 – B
2 – B
3 – B
4 – B
5 – C
6 – B
7 – C
8 – C
9 – C
10 – C