İçindekiler
Kimyasal Bağlar ve Etkileşimler Konu Anlatımı
Maddeleri oluşturan atomlar, doğada tek başına nadiren bulunur. Daha kararlı bir yapıya ulaşmak için kimyasal bağlar oluşturarak diğer atomlarla birleşirler. Atomlar arasındaki bu bağlar, elementlerin ve bileşiklerin fiziksel ve kimyasal özelliklerini belirler.
Bu ünitede iyonik, kovalent ve metalik bağlar gibi temel kimyasal bağ türlerini inceleyeceğiz. Ayrıca moleküller arası zayıf etkileşimleri (Van der Waals ve hidrojen bağları) ve bu bağların maddenin özelliklerine etkilerini öğreneceğiz.
Kimyasal bağları anlamak, maddenin nasıl şekillendiğini, reaksiyonların nasıl gerçekleştiğini ve günlük hayatta karşılaştığımız maddelerin neden farklı özelliklere sahip olduğunu açıklamak için önemlidir.
Kimyasal Bağların Oluşumu ve Bağ Türleri
Maddeleri oluşturan atomlar, daha kararlı bir yapıya ulaşmak için kimyasal bağlar oluşturur. Bu bağlar sayesinde atomlar elektron alışverişi yaparak ya da elektronlarını ortaklaşa kullanarak daha kararlı hale gelirler.
1. Kimyasal Bağların Oluşumu
🔹 Atomlar, soy gazlar (8A grubu) gibi kararlı bir elektron dizilimine ulaşmak ister.
🔹 Bu kararlılık, “Oktet Kuralı” ve “Dublet Kuralı” ile açıklanır.
📌 Oktet Kuralı:
- Bir atom, dış katmanında 8 elektrona ulaşarak kararlı hale gelmeye çalışır.
- Metaller elektron vererek, ametaller ise elektron alarak oktet kuralına uyar.
📌 Dublet Kuralı:
- Hidrojen (H), Helyum (He), Lityum (Li), Berilyum (Be) gibi atomlar dış katmanlarında 2 elektron bulundurarak kararlılığa ulaşır.
📌 Kimyasal bağların oluşma nedenleri:
✔ Atomların enerjisini düşürerek kararlı hale gelmesi
✔ Daha düşük enerji seviyelerine geçerek kararlı bileşikler oluşturması
2. Kimyasal Bağ Türleri
🔹 Kimyasal bağlar, atomlar arasındaki elektron alışverişine veya paylaşımına bağlı olarak iki ana gruba ayrılır:
- Güçlü Bağlar: Atomlar arasında elektron alışverişi veya ortaklaşması ile oluşan bağlardır.
- İyonik bağ
- Kovalent bağ
- Metalik bağ
- Zayıf Etkileşimler: Moleküller arasında oluşan çekim kuvvetleridir.
- Van der Waals kuvvetleri
- Hidrojen bağı
3. Güçlü Kimyasal Bağlar
A) İyonik Bağ (Elektron Alışverişiyle Oluşan Bağ)
📌 Tanım:
- Bir atom elektron vererek (+) yüklü katyon, diğer atom elektron alarak (-) yüklü anyon oluşturur.
- Zıt yüklü iyonlar arasındaki elektrostatik çekim kuvveti iyonik bağı oluşturur.
📌 Örnek:
- NaCl (Sofra Tuzu) → Na⁺ (sodyum katyonu) + Cl⁻ (klor anyonu)
- CaF₂ (Kalsiyum Florür)
📌 Özellikleri:
✔ Genellikle metal + ametal arasında oluşur.
✔ Kristal yapıya sahiptirler.
✔ Suda çözündüğünde iyonlarına ayrışarak iletken hale gelirler.
✔ Erime ve kaynama noktaları yüksektir.
B) Kovalent Bağ (Elektron Paylaşımıyla Oluşan Bağ)
📌 Tanım:
- İki atom, elektronlarını ortaklaşa kullanarak bağ oluşturur.
- Genellikle iki ametal atomu arasında görülür.
📌 Örnek:
- H₂ (Hidrojen gazı)
- O₂ (Oksijen gazı)
- H₂O (Su)
- CO₂ (Karbondioksit)
📌 Kovalent bağın türleri:
- Tekli bağ (H-H, Cl-Cl) → 1 çift elektron paylaşılır.
- Çift bağ (O=O, CO₂) → 2 çift elektron paylaşılır.
- Üçlü bağ (N≡N) → 3 çift elektron paylaşılır.
📌 Özellikleri:
✔ Elektron alışverişi yoktur, elektronlar paylaşılır.
✔ Genellikle sıvı veya gaz hâlde bulunurlar.
✔ Elektrik iletkenlikleri düşüktür.
C) Metalik Bağ (Metaller Arasında Oluşan Bağ)
📌 Tanım:
- Pozitif metal iyonları ile serbestçe hareket eden elektronlar arasındaki çekim kuvvetidir.
- Metallerin esneklik, parlaklık ve iletkenlik gibi özelliklerini belirler.
📌 Örnek:
- Demir (Fe)
- Bakır (Cu)
- Altın (Au)
📌 Özellikleri:
✔ Elektronlar serbest dolaştığı için iyi iletkendirler.
✔ Parlak ve dövülebilir yapıdadırlar.
✔ Yüksek erime ve kaynama noktalarına sahiptirler.
4. Zayıf Etkileşimler (Moleküller Arası Bağlar)
A) Van der Waals Kuvvetleri
📌 Tanım:
- Moleküller arası zayıf çekim kuvvetleridir.
- Maddelerin erime ve kaynama noktalarını etkiler.
📌 Örnek:
- SO₂, CO₂, CH₄ gibi gazların molekülleri arasındaki etkileşimler
📌 Özellikleri:
✔ Apolar moleküller arasındaki en zayıf etkileşimdir.
✔ Düşük sıcaklık ve yüksek basınçta etkisi artar.
B) Hidrojen Bağı
📌 Tanım:
- Hidrojen (H) atomunun, F (Flor), O (Oksijen) veya N (Azot) atomlarıyla yaptığı güçlü zayıf etkileşimdir.
- Su, proteinler ve DNA gibi biyolojik yapılar için hayati öneme sahiptir.
📌 Örnek:
- Su Molekülleri (H₂O)
- Amonyak (NH₃)
- DNA’nın çift sarmal yapısı
📌 Özellikleri:
✔ Su moleküllerinin birbirine tutunmasını sağlar (kohezyon).
✔ Suyun yüksek kaynama noktasına sahip olmasının sebebidir.
✔ DNA sarmalını bir arada tutan bağlardır.
Sonuç:
📌 Güçlü bağlar (iyonik, kovalent, metalik) atomları bir arada tutar.
📌 Zayıf etkileşimler (Van der Waals, hidrojen bağı) moleküller arası çekim kuvvetleridir.
📌 Kimyasal bağlar, maddenin özelliklerini belirler ve kimyasal tepkimeleri anlamamıza yardımcı olur.
İyonik Bağ ve İyonik Bileşikler
İyonik bağ, metal ve ametal atomları arasında elektron alışverişiyle oluşan güçlü bir kimyasal bağdır. Bu bağ, zıt yüklü iyonlar arasındaki elektrostatik çekim kuvvetiyle meydana gelir.
1. İyonik Bağın Oluşumu
📌 Tanım:
- Metaller elektron vererek (+) yüklü katyon,
- Ametaller elektron alarak (-) yüklü anyon oluşturur.
- Zıt yüklerin birbirini çekmesiyle iyonik bağ oluşur.
📌 Örnek: Sodyum Klorür (NaCl) – Sofra Tuzu
- Na (Sodyum) → 1 elektron vererek Na⁺ katyonunu oluşturur.
- Cl (Klor) → 1 elektron alarak Cl⁻ anyonunu oluşturur.
- Na⁺ ve Cl⁻ iyonları arasındaki elektrostatik çekim, NaCl bileşiğini oluşturur.
💡 Genel Formül:
🔹 Metal + Ametal → İyonik Bağlı Bileşik
📌 Diğer Örnekler:
- CaF₂ (Kalsiyum Florür)
- MgO (Magnezyum Oksit)
- KBr (Potasyum Bromür)
2. İyonik Bileşiklerin Özellikleri
📌 1. Kristal Yapı:
✔ İyonik bileşikler katı halde kristal yapıdadır.
✔ İyonlar düzenli bir şekilde dizildiği için sert ve kırılgandır.
📌 2. Yüksek Erime ve Kaynama Noktası:
✔ İyonlar arasındaki güçlü çekim kuvveti nedeniyle erime ve kaynama noktaları yüksektir.
✔ Örnek: NaCl 801°C’de erir.
📌 3. Elektrik İletkenliği:
✔ Katı hâlde iyonlar hareketsiz olduğu için iletken değildir.
✔ Suda çözündüğünde veya erimiş hâlde iletken hâle gelir.
📌 4. Suda Çözünme:
✔ Birçok iyonik bileşik polar çözücülerde (su gibi) çözünerek iyonlarına ayrışır.
✔ Örnek: NaCl (katı) → Na⁺ (suda) + Cl⁻ (suda)
📌 5. Kırılganlık:
✔ İyonik bileşikler darbeye karşı hassastır.
✔ Kristal yapılarında iyonlar kayarsa aynı yükler birbirini iter ve kristal kırılır.
3. İyonik Bağ Kuvveti ve Bağ Enerjisi
İyonik bağın gücü iyonlar arasındaki elektrostatik çekime bağlıdır.
📌 Bağ kuvvetini etkileyen faktörler:
🔹 İyon Yükü: Yük ne kadar büyükse, çekim kuvveti o kadar fazladır.
🔹 İyon Yarıçapı: Küçük iyonlar daha güçlü bağ oluşturur.
📌 Örnek:
- MgO (Magnezyum Oksit) → Mg²⁺ ve O²⁻ iyonları içerdiğinden çok güçlü bir iyonik bağa sahiptir.
- NaCl (Sodyum Klorür) → Na⁺ ve Cl⁻ iyonları içerdiği için MgO’ya göre daha zayıf iyonik bağa sahiptir.
4. İyonik Bileşiklerin Formüllerinin Yazılması
📌 İyon yükleri dengelenerek bileşiğin formülü yazılır.
📌 Örnekler:
- K⁺ ve O²⁻ → K₂O (Potasyum Oksit)
- Ca²⁺ ve Cl⁻ → CaCl₂ (Kalsiyum Klorür)
- Al³⁺ ve S²⁻ → Al₂S₃ (Alüminyum Sülfür)
⚠ İpucu:
- Katyon (metal) her zaman önce yazılır.
- Yükler denge sağlanacak şekilde çaprazlanır.
Sonuç:
✔ İyonik bağ, metal ve ametal atomları arasında elektron alışverişi ile oluşur.
✔ İyonik bileşikler kristal yapılı, yüksek erime noktalı ve suda çözündüğünde iletken bileşiklerdir.
✔ İyon yükü ve iyon yarıçapı bağ kuvvetini etkiler.
Kovalent Bağ ve Kovalent Bileşikler
Kovalent bağ, iki ametal atomu arasında elektronların ortaklaşa kullanılmasıyla oluşan bir bağ türüdür. Atomlar, kararlı hale gelmek için elektronlarını paylaşarak kovalent bağlı bileşikleri oluşturur.
1. Kovalent Bağın Oluşumu
📌 Tanım:
- İki ametal atomu arasında elektronların ortak kullanılmasıyla oluşur.
- Elektron alışverişi yoktur, yalnızca paylaşım vardır.
📌 Örnek: H₂ Molekülünün Oluşumu
- H atomları tek elektronlarını ortak kullanarak H₂ molekülünü oluşturur.
- Elektron paylaşımı ile oktet veya dublet kuralına uyulur.
💡 Genel Formül:
🔹 Ametal + Ametal → Kovalent Bağlı Bileşik
📌 Diğer Örnekler:
- O₂ (Oksijen gazı)
- N₂ (Azot gazı)
- H₂O (Su molekülü)
- CH₄ (Metan gazı)
2. Kovalent Bağın Türleri
Kovalent bağlar, paylaşılan elektron çiftlerinin sayısına göre sınıflandırılır:
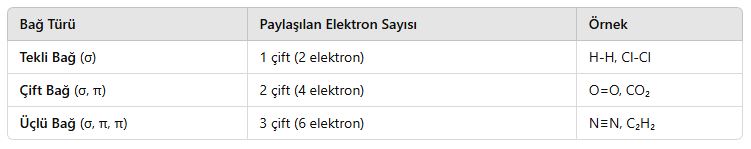
📌 Örnek:
- Tekli bağ: H₂ (H-H)
- Çift bağ: O₂ (O=O)
- Üçlü bağ: N₂ (N≡N)
⚠ Not: Bağ sayısı arttıkça bağ kuvveti artar, ancak bağ uzunluğu kısalır.
3. Kovalent Bileşiklerin Özellikleri
📌 1. Elektron Paylaşımı:
✔ Atomlar elektronlarını ortaklaşa kullanır.
📌 2. Fiziksel Hâl:
✔ Kovalent bileşikler genellikle gaz veya sıvıdır.
✔ Katı olan kovalent bileşikler kristal yapıdadır (örneğin elmas, grafit).
📌 3. Erime ve Kaynama Noktası:
✔ İyonik bileşiklere göre daha düşük erime ve kaynama noktalarına sahiptirler.
📌 4. Elektrik İletkenliği:
✔ Suda çözündüklerinde iyon oluşturmadıkları için elektrik akımını iletmezler.
📌 5. Suda Çözünme:
✔ Polar kovalent bileşikler suda çözünürken, apolar olanlar çözünmez.
✔ Örnek: H₂O çözünür, CH₄ çözünmez.
4. Polar ve Apolar Kovalent Bağlar
📌 A) Apolar Kovalent Bağ
- Aynı cins ametaller arasında elektronların eşit paylaşılmasıyla oluşur.
- Örnek: H₂, O₂, N₂, Cl₂
- Elektronegatiflik farkı yoktur (0’dır).
📌 B) Polar Kovalent Bağ
- Farklı cins ametaller arasında oluşur, elektronlar eşit paylaşılmaz.
- Elektronegatifliği yüksek olan atom, elektronları kendine doğru daha fazla çeker.
- Örnek: H₂O, HF, NH₃, CO₂
- Elektronegatiflik farkı 0 ile 1,7 arasındadır.
💡 Kıyaslama:

5. Özel Kovalent Yapılar
📌 1. Koordinatif Kovalent Bağ (Dative Bağ)
✔ Bir atom, bağ için gerekli elektron çiftinin tamamını karşılıyorsa koordinatif bağ oluşur.
✔ Örnek: NH₄⁺, H₃O⁺, CO
📌 2. Dev Kristal Kovalent Yapılar
✔ Elmas (C), Grafit (C) ve Silisyum Dioksit (SiO₂) gibi maddeler çok güçlü kovalent bağlara sahiptir.
✔ Bu yapılar sert, yüksek erime noktalı ve iletkenlik özellikleri farklıdır.
📌 Özel Örnekler:
- Elmas (C) → Sert, yalıtkan
- Grafit (C) → Yumuşak, iletken
- Kuvars (SiO₂) → Sert, yalıtkan
Sonuç:
✔ Kovalent bağ, elektron paylaşımıyla oluşan bağdır.
✔ Apolar kovalent bağda elektronlar eşit paylaşılır, polar kovalent bağda paylaşım eşit değildir.
✔ Kovalent bileşikler genellikle gaz veya sıvıdır, iyonik bileşiklere göre daha düşük erime ve kaynama noktasına sahiptir.
Metalik Bağ ve Metalik Özellikler
Metaller, doğada serbest halde ya da bileşikler halinde bulunur ve kendilerine özgü fiziksel ve kimyasal özelliklere sahiptirler. Metalik bağ, metal atomları arasında oluşan özel bir bağ türüdür ve metallerin iletkenlik, dövülebilirlik ve parlaklık gibi özelliklerini belirler.
1. Metalik Bağın Oluşumu
📌 Tanım:
- Metaller, dış katmanlarındaki elektronlarını serbest bırakır ve bu elektronlar metal atomları arasında serbestçe hareket eder.
- Pozitif metal iyonları (katyonlar), negatif yüklü elektron denizi içinde bir arada tutulur.
- Bu yapı, metallere özgü fiziksel özellikleri kazandırır.
📌 Örnek:
- Demir (Fe)
- Bakır (Cu)
- Altın (Au)
💡 Metalik Bağın Yapısı:
🔹 Pozitif metal iyonları (+)
🔹 Negatif elektron denizi (-)
🔹 Bu elektrostatik çekim metalik bağı oluşturur.
2. Metalik Bağın Özellikleri
📌 1. Elektrik ve Isı İletkenliği:
✔ Metaller, elektrik ve ısıyı çok iyi iletir.
✔ Elektronlar serbestçe hareket edebildiği için elektron akışı kolaydır.
📌 2. Esneklik ve Dövülebilirlik:
✔ Metal atomları serbest elektronlarla bağlı olduğu için kolayca şekil alabilir.
✔ Metaller dövülebilir, tel ve levha hâline getirilebilir.
📌 3. Parlaklık ve Yüzey Özellikleri:
✔ Metaller ışığı iyi yansıtır, bu nedenle parlaktır.
✔ Gümüş ve altın gibi metaller yüksek parlaklığa sahiptir.
📌 4. Erime ve Kaynama Noktası:
✔ Metalik bağın kuvvetine bağlı olarak yüksek erime ve kaynama noktalarına sahiptirler.
✔ Örnek:
- Tungsten (W) → 3422°C (yüksek erime noktası)
- Cıva (Hg) → -39°C (düşük erime noktası)
📌 5. Metalik Bağ Kuvveti:
✔ Metalin çekirdek yükü ve elektron sayısı arttıkça bağ kuvveti artar.
✔ Örnek: Na < Mg < Al (Metalik bağ kuvveti sıralaması)
3. Alaşımlar ve Metalik Özellikler
📌 Alaşımlar Nedir?
✔ İki veya daha fazla metalin karıştırılmasıyla oluşan yeni bir metalik malzemedir.
✔ Alaşımlar, saf metallere göre daha dayanıklı ve kullanışlıdır.
📌 Örnek Alaşımlar:
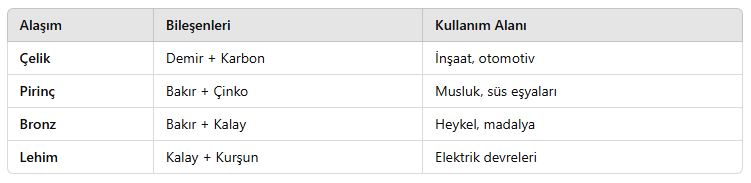
Sonuç:
✔ Metalik bağ, metal atomları arasındaki serbest elektronlar tarafından oluşturulur.
✔ Metaller elektrik ve ısıyı iyi iletir, dövülebilir ve parlaktır.
✔ Metallerin erime noktaları metalik bağ kuvvetine bağlıdır.
✔ Alaşımlar, metallerin özelliklerini iyileştirmek için kullanılır.
Zayıf Etkileşimler: Van der Waals ve Hidrojen Bağları
Kimyasal bağlar, atomları ve molekülleri bir arada tutan kuvvetlerdir. İyonik, kovalent ve metalik bağlar güçlü bağlar olarak sınıflandırılırken, zayıf etkileşimler moleküller arasında daha düşük enerjili çekim kuvvetleri oluşturan etkileşimlerdir.
Zayıf etkileşimler, maddenin erime ve kaynama noktası, çözünürlük, yüzey gerilimi ve fiziksel hâl değişimleri gibi özelliklerini etkiler.
1. Van der Waals Etkileşimleri
📌 Tanım:
- Moleküller arasında oluşan zayıf çekim kuvvetleridir.
- Elektron hareketleri nedeniyle moleküller geçici veya kalıcı dipoller oluşturur.
📌 Van der Waals Kuvvetlerinin Türleri:

📌 Örnekler:
- O₂, CO₂, CH₄ → London kuvvetleri ile bağlanır.
- HCl, SO₂ → Dipol-dipol etkileşimi gösterir.
- Tuzun (NaCl) suda çözünmesi → İyon-dipol etkileşimi sayesinde olur.
📌 Özellikleri:
✔ En zayıf etkileşimlerdir.
✔ Apolar moleküllerde genellikle London kuvvetleri görülür.
✔ Maddenin fiziksel hâlini ve çözünürlüğünü etkiler.
2. Hidrojen Bağı
📌 Tanım:
- Hidrojen atomunun (H), F (Flor), O (Oksijen) veya N (Azot) gibi elektronegatif atomlarla yaptığı güçlü zayıf etkileşimdir.
- Su, proteinler, DNA gibi biyolojik sistemler için çok önemlidir.
📌 Örnekler:
- Su molekülleri (H₂O) arasında hidrojen bağı vardır.
- DNA’nın çift sarmalı, hidrojen bağları ile bir arada tutulur.
- Amonyak (NH₃), hidrojen florür (HF) hidrojen bağı içerir.
📌 Özellikleri:
✔ Van der Waals kuvvetlerinden daha güçlüdür.
✔ Kaynama ve erime noktalarını artırır.
✔ Suyun yüzey gerilimini ve yoğunluğunu belirler.
Sonuç:
✔ Van der Waals etkileşimleri, moleküller arasındaki en zayıf kuvvetlerdir.
✔ Hidrojen bağları, su gibi maddelerin özelliklerini belirleyen önemli zayıf etkileşimlerdir.
✔ Zayıf etkileşimler, maddenin fiziksel özelliklerini belirler ancak kimyasal değişim oluşturmaz.
Kimyasal Bağlar ve Etkileşimler Testi
1. Aşağıdaki bağ türlerinden hangisi elektron paylaşımı ile oluşur?
A) İyonik bağ
B) Kovalent bağ
C) Metalik bağ
D) Van der Waals etkileşimi
2. NaCl bileşiğinin iyonik bağ oluşturmasının temel sebebi nedir?
A) Na ve Cl’nin aynı element olması
B) Elektronların ortaklaşa kullanılması
C) Na’nın elektron verip katyon, Cl’nin elektron alıp anyon oluşturması
D) Na ve Cl arasında Van der Waals kuvvetlerinin bulunması
3. Aşağıdaki bileşiklerden hangisi apolar kovalent bağ içerir?
A) H₂O
B) O₂
C) CO₂
D) HF
4. Hangisi metalik bağın özelliklerinden biri değildir?
A) Elektronların serbest hareket etmesi
B) Yüksek elektrik iletkenliği
C) Apolar moleküller arasında oluşması
D) Dövülebilir ve tel haline getirilebilir olması
5. Hidrojen bağı hangi elementler arasında görülür?
A) Hidrojen ile sadece oksijen arasında
B) Hidrojen ile F, O ve N arasında
C) Hidrojen ile tüm ametaller arasında
D) Hidrojen ile metaller arasında
6. Aşağıdaki bileşiklerden hangisi iyonik bağlı bir bileşiktir?
A) HCl
B) H₂O
C) NaBr
D) CO₂
7. Van der Waals kuvvetleri en çok hangi tür moleküllerde etkilidir?
A) Apolar moleküllerde
B) İyonik bileşiklerde
C) Metalik bileşiklerde
D) Sadece hidrojen bağı içeren moleküllerde
8. Elektronegatiflik farkı en büyük olan bağ türü hangisidir?
A) İyonik bağ
B) Apolar kovalent bağ
C) Polar kovalent bağ
D) Metalik bağ
9. Aşağıdaki maddelerden hangisi metalik bağ içerir?
A) O₂
B) Cu
C) CH₄
D) NaCl
10. Aşağıdaki ifadelerden hangisi doğrudur?
A) Kovalent bağlar yalnızca tekli bağ olarak bulunur.
B) Metalik bağlar yalnızca saf metaller arasında oluşur.
C) İyonik bileşikler sulu çözeltilerde elektrik iletmez.
D) Hidrojen bağı, suyun kaynama noktasının yüksek olmasının nedenlerinden biridir.
Cevap Anahtarı
1 – B
2 – C
3 – B
4 – C
5 – B
6 – C
7 – A
8 – A
9 – B
10 – D
